
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Титрування сильної кислоти сильною основою
|
|
|
|
Криві титрування кислот, основ, солей, що гідролізуються. Принцип розрахунку кривих титрування та підбору підходящого індикатора для титрування. Кислотно-основне титрування в неводному середовищі
Побудуємо криву титрування 100 мл 0,1н розчину HCl 0,1 н розчином NaOH. Не враховуємо розведення і іонну силу розчину. Реакція перебігає згідно рівняння:
HCl + NaOH  NaCl + H2O.
NaCl + H2O.
До початку титрування у розчині знаходиться тільки сильна кислота і рН розчину pH = -lgCK = 1.
До точки еквівалентності рН розчину буде залежати від концентрації іонів гідрогену, яка залежить від концентрації кислоти, а вона, у свою чергу, залежить від кількості доданого лугу. При однаковій концентрації реагуючих речовин еквівалентна концентрація розчину:
N =  .
.
Якщо додати 90 мл титранту Ск = Nв.р.=0,1*0.1=0,01, рН = 2 (не враховуючи розведення). При додаванні 99 мл - рН=3, а при Vст.р. = 99,9 мл, рН=4.
В точці еквівалентності у розчині не буде ні кислоти ні основи, а тільки сіль NaCl, яка не гідролізується, і у розчині рН=7. Точка еквівалентності буде досягнута при однакових об’ємах реагуючих розчинів VNAOH = VHCl = 100мл, оскільки початкові концентрації розчинів рівні.
Це виконується для температури 250С, тому що при цій температурі іонний добуток води Кw =10-14. З підвищенням температури іонний добуток води зростає і при 800С Кw =2,4*10-13 і рН = -lg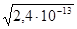 =6,31.
=6,31.
Після точки еквівалентності у розчині буде тільки основа, рН буде залежати від кількості надлишку доданого лугу і розраховуватися за формулою pH = 14-pOH. При додаванні 100,1 мл титранту, у розчин об’ємом 100 мл додали надлишок лугу об’ємом 0,1 мл. Оскільки титрують 0,1 н. лугом, то кінцева концентрація NaOH буде в 1000 разів менша. Виходячи з цього рН розчину дорівнює: [OH−] = CNaOH = 0,0001 моль/л =10-4; pOH = 4; pH =14-4= 10.
|
|
|
Аналогічно розраховуються подальші значення рН при титруванні: при додаванні 101 мл NaOH – рН = 11, 110 мл NaOH – рН = 12, 200 мл NaOH – рН = 13.
Крива титрування сильної кислоти сильною основою наведена на рис. 2.5.
Аналіз кривої титрування дозволяє зробити наступні висновки:
1.Крива титрування симетрична лінії нейтральності.
2.Точка еквівалентності знаходиться на лінії нейтральності.
3.Точка еквівалентності знаходиться на стрибку титрування, величина якого дорівнює висоті вертикальної ділянки кривої титрування.

Рисунок 2.5 – Крива титрування сильної кислоти сильною основою
4.Чим більше концентрації кислоти і основи, тим більше висота стрибка титрування.
5.В якості індикатора придатні і метилоранж і фенолфталеїн.
Зрозуміло, що крива титрування сильної основи сильною кислотою буде дзеркальним відображенням кривої титрування сильної кислоти сильною основою.
Титрування слабої кислоти сильною основою. Побудуємо криву титрування 100 мл 0,1н розчину CH3COOH(Кк=1,74*10-5) 0,1 н розчином NaOH. Реакція перебігає згідно рівняння:
CH3COOH + NaOH  CH3COONa + H2O.
CH3COONa + H2O.
До початку титрування у розчині знаходиться тільки слаба кислота і рН розчину 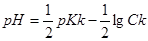
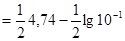 =2,87.
=2,87.
До точки еквівалентності у розчині одночасно знаходяться слаба кислота і її сіль, отже буферний розчин. рН розчину буде залежати від концентрації кислоти і солі і розраховується за формулою:
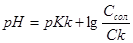 .
.
Якщо додати 50 мл титранту Ск = Ссол, тоді рН=рКк =4,74.
В точці еквівалентності у розчині не буде ні кислоти ні основи, а тільки сіль CH3COONa, яка гідролізується, і рН якої визначається за формулою:
рН = 7 + 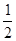 рКк +
рКк +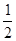 lgCсол.
lgCсол.
У точці еквівалентності концентрація солі буде дорівнювати концентрації кислоти, отже рН = 7+2,37-0,5=8,87 і точка еквівалентності знаходиться у лужному середовищі.
Після точки еквівалентності крива титрування буде мати вигляд як і у попередньому випадку.
Крива титрування слабої кислоти сильною основою наведена на рис.2.6.
|
|
|
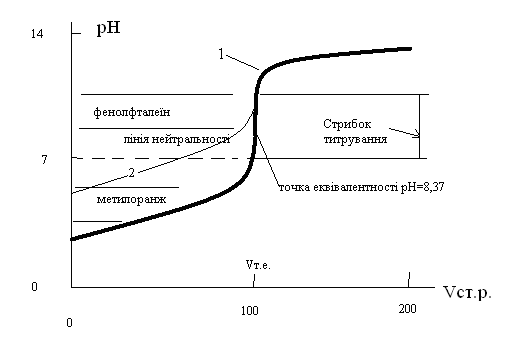
1-крива титрування кислоти з Кк=1,74*10-5,
2-крива титрування кислоти з Кк 1*10-7
1*10-7
Рисунок 2.6 - Крива титрування слабої кислоти сильною основою
Аналіз кривої титрування дозволяє зробити наступні висновки:
1.Крива титрування не симетрична лінії нейтральності.
2.Точка еквівалентності знаходиться не на лінії нейтральності а в лужному середовищі.
3.Величина стрибку титрування менше ніж у випадку титрування сильної кислоти. Причому, чим менше константа дисоціації, тим менше висота стрибка титрування. Крива 2 відповідає титруванню кислоти з Кк 1*10-7 і при Кк <1*10-9 стрибок титрування практично зникає. Тому кислотно-основне титрування придатне для титрування слабких кислот і основ,які мають константу дисоціації більше ніж К >1*10-8.
1*10-7 і при Кк <1*10-9 стрибок титрування практично зникає. Тому кислотно-основне титрування придатне для титрування слабких кислот і основ,які мають константу дисоціації більше ніж К >1*10-8.
4.В якості індикатора використовується фенолфталеїн.
Аналогічним чином з використанням відповідних рівнянь можна побудувати криву титрування слабкої основи сильною кислотою. Якщо титрувати 100мл 0,1 н розчину NH4OH (Косн. =1,76*10-5 рКосн. =4.74) 0,1 н розчином HCl то крива титрування буде мати вигляд, який зображено на рис. 2.3.(являти собою дзеркальне відображення попередньої кривої титрування). В цьому випадку у точці еквівалентності утворюється сіль NH4Cl, яка гідролізується по катіону.
Крива титрування слабої основи сильною кислотою наведена на рис.2.7.
Аналіз кривої титрування дозволяє зробити наступні висновки:
1.Крива титрування не симетрична лінії нейтральності.
2.Точка еквівалентності знаходиться не на лінії нейтральності а в кислому середовищі.
3.Величина стрибку титрування менше ніж у випадку титрування сильної кислоти.
4.В якості індикатора використовується метилоранж.

Рисунок 2.7 – Крива титрування слабкої основи сильною кислотою
Титрування багато основних кислот. Титрування багато основних кислот перебігає по ступеням, як і їх дисоціація. Наприклад, при титруванні 100 мл 0,1 н фосфатної кислоти 0,1 н розчином NaOH маємо три точки еквівалентності, які відповідають додаванню на кожний моль кислоти 1, 2 і 3 моль(відповідно 100, 200 і 300 мл) основи з утворенням різних солей. При цьому перебігають такі реакції:
H3PO4 + NaOH  NaH2PO4+ H2O, К1к=7,6*10-3, рК1к =2,12;
NaH2PO4+ H2O, К1к=7,6*10-3, рК1к =2,12;
NaH2PO4 + NaOH  Na2HPO4 + H2O, К2к=6,2*10-8, рК2к =7,21;
Na2HPO4 + H2O, К2к=6,2*10-8, рК2к =7,21;
|
|
|
Na2HPO4 + NaOH  Na3PO4 + H2O, К3к=4,2*10-13, рК3к =12,38.
Na3PO4 + H2O, К3к=4,2*10-13, рК3к =12,38.
Відбувається титрування суміші трьох кислот, які відрізняються за силою.
Відокремлене (диференцьоване) титрування у водному розчині двох кислот може бути виконане, якщо їх константи дисоціації розрізняються у 104 разів:
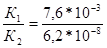 >104;
>104;  >104.
>104.
Тому фосфатну кислоту можна титрувати і як одноосновну і як двоосновну.
Визначимо значення рН розчину у основні моменти титрування.
До початку титрування у розчині знаходиться тільки слаба багато основна кислота. Дисоціація кислоти за першим ступенем значно більше, чим за іншими, тому приблизно рН розчину розраховуємо за формулою:
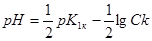
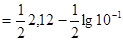 =1,56.
=1,56.
В першій точці еквівалентності у розчині не буде ні H3PO4 ні основи, але буде сіль NaH2PO4, концентрація іонів водню у розчину якої визначається за формулою:
[H+] =  ,
,
а рН по формулі:
рН1т.е. =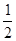 (рК1к+ рК2к) =
(рК1к+ рК2к) = 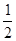 (2,12+7,21)=4,66.
(2,12+7,21)=4,66.
Перша точка еквівалентності фіксується по індикатору метилоранжу.
У другій точці еквівалентності у розчині буде тільки сіль Na2HPO4, рН розчину якої:
рН2т.е . =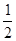 (рК2к+ рК3к) =
(рК2к+ рК3к) = 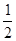 (7,21 + 12,38)=9,8.
(7,21 + 12,38)=9,8.
Друга точка еквівалентності фіксується по індикатору фенолфталеїну.
В третій точці еквівалентності у розчині присутня тільки сіль Na3PO4, яка гідролізується і рН розчину:
рН3т.е. = 7 + 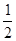 рКк +
рКк +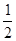 lgCсол = 7 +
lgCсол = 7 + 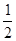 12,38 +
12,38 +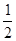 lg0,1= 12,7.
lg0,1= 12,7.
Зазначимо, що константа дисоціації H3PO4 за третім ступенем вельми мала, а отже титрувати її як 3-основну звичайно неможливо, внаслідок відсутності 3-ого стрибка титрування.
Крива титрування фосфатної кислоти сильною основою наведена на рис.2.8.

Рисунок 2.8 – Крива титрування фосфатної кислоти сильною основою
Титрування солей, що гідролізуються. Метод кислотно-основного титрування може використовуватися і для визначення солей, які підкорюються гідролізу. Якщо рК слабої кислоти чи слабої основи, що входить до складу солі, >8, то її водний розчин можна титрувати безпосередньо. Якщо сіль утворена більш сильними кислотами чи основами(рК <8)використовують метод зворотного титрування, метод заміщення, або метод відгонки. Розглянемо криву титрування 100мл 0,1 н розчину Na2CO3(К1к =4,5*10-7, рК1к =6,35; К2к = 4,8*10-11, рК2к =10,32) 0,1 н розчином HCl. На кривій титрування буде мати місце 2 стрибки титрування, які відповідають:
|
|
|
1.Утворенню NaHCO3:
Na2CO3 + HCl  NaHCO3 + NaCl.
NaHCO3 + NaCl.
2.Утворенню слабої кислоти H2CO3:
NaHCO3 + HCl  H2CO3 + NaCl.
H2CO3 + NaCl.
До початку титрування у розчині знаходиться тільки сіль, рН розчину якої визначаємо за формулою:
рН = 7 + 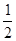 рК2к +
рК2к +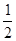 lgCсол = 7 +
lgCсол = 7 + 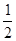 10,32 +
10,32 +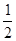 lg0,1= 11,66.
lg0,1= 11,66.
В першій точці еквівалентності у розчині буде сіль NaHCO3, рН якої розраховується за формулою:
рН1т.е. =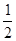 (рК1к+ рК2к) =
(рК1к+ рК2к) = 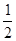 (6,35+10,32)=8,33.
(6,35+10,32)=8,33.
Цей момент фіксується за допомогою індикатору фенолфталеїну. Молярна маса еквіваленту Na2CO3 при титруванні за фенолфталеїном буде дорівнювати молярній масі(фактор еквівалентності f =1).
В другій точці еквівалентності у розчині присутня тільки слаба кислота:

 =3,75.
=3,75.
Цей момент фіксується по індикатору метилоранжу. Молярна маса еквіваленту Na2CO3 при титруванні за метилоранжем буде дорівнювати ½ молярній масі(фактор еквівалентності f =1/2).
Крива титрування карбонату натрію стандартним розчином HCl наведена на рис. 2.7.

Рисунок 2.9 – Крива титрування карбонату натрію сильною кислотою
Метод кислотно-основного титрування використовується для визначення нітрогену в аналізі речовин рослинного і тваринного походження, технічних матеріалах, добривах, визначені кислотності хлібу, молока, аналізі органічних і неорганічних кислот і основ.
Самостійно опрацювати тему більш детальніше за літературою:
[2] – стор. 52-76; [4] – стор. 40-60; [8] – стор. 74-157.
Контрольні питання до теми 2.5С
5.1.Проаналізуйте криву титрування сильної кислоти сильною основою. Чому дорівнює значення рН точки еквівалентності у цьому випадку?
5.2.Проаналізуйте криву титрування слабої кислоти сильною основою. Чому дорівнює значення рН точки еквівалентності у цьому випадку?
5.3.Проаналізуйте криву титрування слабої основи сильною кислотою. Чому дорівнює значення рН точки еквівалентності у цьому випадку?
5.4.Проаналізуйте криву титрування фосфатної кислоти сильною основою. Чому дорівнює значення рН точки еквівалентності у цьому випадку?
5.5.Проаналізуйте криву титрування карбонату натрію сильною кислотою. Чому дорівнює значення рН точки еквівалентності у цьому випадку?
5.6.Наведіть приклади використання методу кислотно-основного титрування.
|
|
|
|
Дата добавления: 2014-01-06; Просмотров: 5335; Нарушение авторских прав?; Мы поможем в написании вашей работы!