
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 5
|
|
|
|
Изучение механизма цепных реакций. Польза от измерения неактивированной хемилюминесценции несомненна при изучении механизма цепного окисления липидов в мембранах и липопротеинах плазмы крови. Реакции цепного окисления отличаются большой сложностью и включают в себя целый ряд быстропротекающих стадий. Главные участники реакций, свободные радикалы, обычными методами химического анализа определены быть не могут из-за своей чрезвычайно высокой реакционной способности, а следовательно – неустойчивости в биохимических системах.
Природа химических реакций, обуславливающих свечение, был понята далеко не всегда. Наибольшее число публикаций в литературе посвящено свечению плазмы крови, к которой для инициирования цепного окисления липидов добавляли соли двухвалентного железа. Амплитуда сигнала хемилюминесценции хорошо коррелировала с количеством продуктов перекисного окисления липидов, определяемых химическим методом, и зависела от липидного состава плазмы крови и концентрации в ней антиоксидантов, т.е. веществ, тормозящих процессы, идущие с участием свободных радикалов.
Сверхслабое» свечение клеток и тканей. Низкая интенсивность хемилюминесценции, сопровождающей реакции свободных радикалов объясняется тремя причинами. Во-первых, сама концентрация радикалов в биологических системах очень мала из-за их высокой химической активности, поэтому малы и скорости реакций, сопровождающихся свечением. Во-вторых, не всякое химическое взаимодействие радикалов непременно приводит к образованию электронно-возбужденных молекул продуктов реакции. Напротив, в подавляющем большинстве окислительно-восстановительных взаимодействий между молекулами или радикалами электрон переносится не на уровень возбужденного состояния, а на самый нижний свободный уровень, и последующего высвечивания кванта не происходит. В третьих, даже если и образовалась возбужденная молекула продукта, вероятность того, что высветится квант, а не произойдет растраты энергии в тепло, тоже обычно очень мала. Две последние причины приводят к тому, что квантовый выход хемилюминесценции в случае, скажем, реакции двух перекисных радикалов составляет всего 10-8-10-10. Это происходит потому, что квантовый выход образования возбужденных молекул продукта
|
|
|
Реакции с участием активных форм кислорода. Активными формами кислорода (АФК) обычно называют перекись водорода (H2O2), гипохлорит (ClO-) и кислородные радикалы: супероксид (·OO-) и радикал гидроксила (HO-). Главным источником АФК в организме человека и животных служат клетки-фагоциты: гранулоциты и моноциты крови и тканевые макрофаги.
Мембраны фагоцитов содержат ферментативный комплекс (НАДФН–оксидазу), который окисляет НАДФН до НАДФ+ за счет восстановления двух молекул кислорода до супероксидного радикала:
| НАДФН + 2O2 -> НАДФ+ + 2O2•– |
При взаимодействии (диспропорционировании) двух супероксидных радикалов образуется перекись водорода и кислород:

|
Фагоцит выделяет в окружающую среду не только АФК, но и ряд ферментов, среди которых важнейший - миелопероксидаза, катализирующая реакцию образования гипохлорита из аниона хлора и перекиси водорода:

|
Кроме того, в присутствие ионов металлов переменной валентности, например железа, происходит образование радикалов гидроксила из перекиси водорода (реакция Фентона) и гипохлорита (реакция Осипова):
| H2O2 + Fe2+ -> Fe3+ + HO- + HO· |
| ClO- + Fe2+ + H+ -> Fe3+ + Cl- + HO· |
Таким образом, активированные фагоциты для борьбы с чужеродными клетками образуют целый букет активных форм кислорода, которые, как оказалось, могут взаимодействовать друг с другом и с другими молекулами с испусканием квантов хемилюминесценции.
|
|
|
Собственная хемилюминесценция активированных фагоцитов была открыта Р. Элленом (R. Allen) и сотрудниками в 1972 году. Непосредственной причиной такого свечения обычно считают образование синглетного кислорода в реакциях между кислородными радикалами, перекисью водорода и гипохлоритом. Действительно известно, что весьма интенсивная хемилюминесценция сопровождает реакцию гипохлорита и перекиси водорода, в которой образуются молекулы кислорода в возбужденном (синглетном) состоянии (1O2):
| ClO- + H2O2 -> Cl- + H2O + 1O2 |
Синглетный кислород переходит в основное (триплетное) состояние кислорода с испусканием кванта света (хемилюминесценции) в инфракрасной области спектра (длина волны 1270 нм).
| 1O2 -> 3O2 + фотон (1270 нм) |
Кроме того, молекулы синглетного кислорода могут образовывать возбужденные димеры (так называемые эксимеры) кислорода, которые переходят в основное состояние с испусканием видимого света (длины волн 635, 580, 535 нм). Синглетный кислород может образовываться также при взаимодействии кислородных радикалов:
| •O2- + •O2- + 2H+ -> H2O2 + 1O2 |
| •O2- + HO·+ H+ -> H2O + 1O2 |
Наряду с реакциями активных форм кислорода, вклад в собственную ХЛ фагоцитов могут вносить реакции цепного окисления липидов и реакции пероксинитрита.
Свечение при реакциях цепного окисления липидов. Одна из главных составляющих собственной (неактивированной) хемилюминесценции животных клеток и тканей – свечение, сопровождающее цепное окисление липидов в мембранных структурах клеток и липопротеинах крови. Эта реакция идет с участием свободных радикалов липидов L·и липопероксидов LOO·, которые как бы "ведут" цепи окисления. Время от времени радикалы, ведущие цепь окисления, взаимодействуют друг с другом.
В реакции взаимодействия двух радикалов липопероксида (LOO·) образуются молекулы кетона и кислорода в электронно-возбужденном состоянии, которые затем переходят в основное состояние, испуская квант света (фотон):
| LOO· + LOO· -> LOH + L=O* + 1O2 |
| L=O* -> L=O + hn1 (420–520 нм) |
| 1O2 -> 3O2 + hn2 (1270 нм) |
| 1O2 + 1O2 -> [(O2)2]* (эксимер кислорода) |
| [(O2)2]* -> 2O2 + hn3 (480, 540, 640 нм) |
Чем больше радикалов липопероксида (LOO·) в системе, то есть чем энергичнее идут цепные реакции окисления липидов, тем выше интенсивность хемилюминесценции, сопровождающей реакцию радикалов.
|
|
|
Вещества, реагирующие со свободными радикалами и тем самым тормозящие цепное окисление липидов (так называемые антиоксиданты), одновременно подавляют хемилюминесценцию. Именно подавление собственной хемилюминесценции тканей и клеток такими антиоксидантами, как например токоферол (витамин Е), указывает на то, что это свечение обусловлено реакциями цепного окисления липидов.
С другой стороны, изучая влияние различных природных и синтетических соединений на течение во времени (кинетику) ХЛ, можно судить о способности этих веществ защищать наш организм от вредного действия свободных радикалов и тем самым отбирать кандидатов на определенные лекарства.
Хемилюминесценция в реакциях с участием окиси азота. Окись азота NO – это газ, хорошо растворимый в воде и обладающий высокой реакционной способностью; последнее связано с тем, что NO – свободный радикал (·NO). Само открытие выделения окиси азота клетками человека и животных было сделано в 1984 году методом хемилюминесценции, правда не в растворе, а в газовой фазе.
При смешивании окиси азота и озона наблюдается яркая хемилюминесценция, и в восьмидесятые годы газовые хемилюминометры для определения окиси азота выпускались в промышленном масштабе. К концу восьмидесятых годов биологическая роль окиси азота уже ни для кого не была секретом. Его первая расшифрованная функция – расслабление стенок кровеносных сосудов (вазодилатация), которое в свою очередь приводит к улучшению кровоснабжения органов и снижению общего кровяного давления. Вскоре оказалось, что окись азоты выделяется клетками-фагоцитами и участвует в борьбе с организма-хозяина с микроорганизмами.
Сейчас хорошо известно, что окись азота выделяется очень многими типами клеток и является одним из основных регуляторов внутриклеточных процессов.
|
|
|
Участие реакций нитроксида в собственной хемилюминесценции тканей животных было показано в опытах Джулио Терренса и сотрудников, которые изучали свечение перфузируемого легкого. Оказалось, что свечение снижается очень существенно (на 85%!) при введении в перфузат нитро-L-аргинина, ингибитора NO-синтазы (фермента, катализирующего образование окиси азота в живых клетках).
Свечение удавалось наблюдать также и в растворах, содержащих окись азота, супероксидные радикалы и какой-нибудь белок.
Между тем известно, что при реакции окиси азота и супероксида образуется пероксинитрит, очень токсичное соединение;
| •N=O + •O-O- + H+ -> O=N-O-OH (пероксинитрит) |
Реакция пероксинитрита с белком приводит к свечению, которое вносит существенный вклад в свечение всего органа.
Природа процессов, определяющих собственное свечение тканей, может меняться при изменении состояния этой ткани. В опытах того же автора было показано, что у животных с воспалением легких ингибитор NO-синтазы слабо влиял на свечение органа, зато свечение снижалось антиоксидантами – супероксиддисмутазой и ловушками липидных радикалов.
Таким образом, при воспалении на первый план выходят реакции, связанные с активацией клеток-фагоцитов и образованием ими активных форм кислорода, а затем – липидных перекисей, тогда как в норме за свечение ответственны реакции окиси азота.
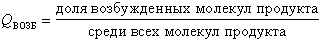
|
равен всего 10-4-10-5, а квантовый выход люминесценции продукта
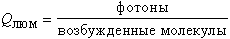
|
составляет для кетонов, образующихся при взаимодействии перекисных радикалов, в свою очередь, тоже около 10-4-10-5. Выходит, что общий квантовый выход хемилюминесценции составляет всего QХЛ = QВОЗБ · QЛЮМ = 10-8-10-10. Отсюда становится понятной стратегия для использования хемилюминесценции как метода обнаружения радикалов. Для усиления свечения, т.е. QХЛ, надо увеличить или QВОЗБ или QЛЮМ или и то и другое.
Соединения, которые реагируют с радикалами с образованием возбужденных молекул продуктов, такие как люминол или люцигенин, называют химическими активаторами ХЛ, или хемилюминогенными зондами. Они как бы увеличивают QВОЗБ. Существуют и такие вещества, которые перехватывают возбужденные состояния продуктов и высвечивают кванты с высоким выходом (т.е. как бы увеличивают QЛЮМ); их можно назвать физическими активаторами ХЛ.
Применение собственной (неактивированной) хемилюминесценции. Возможности лабораторного клинического анализа. Почти сразу после того, как появились первые работы по собственной "сверхслабой" хемилюминесценции клеток и тканей, были сделаны попытки использовать этот показатель в целях клинической диагностики. Первым объектом была цельная кровь и плазма крови больных людей. Поскольку собственное свечение было очень слабым и измерять его было трудно, было сделано много попыток усилить это свечение: к плазме крови добавляли красители, перекись водорода, ионы двухвалентного железа и т. д.
Во многих случаях данные таких анализов были признаны ценными в качестве дополнительных при постановке врачом диагноза заболевания, контроля за эффективностью лечения и прогноза течения болезни. И все же измерение неактивированной хемилюминесценции в широкую клиническую практику пока не вошло, в отличие от хемилюминесценции в присутствии активаторов.
Между тем измерение хемилюминесценции как раз и позволяет оценивать концентрацию липидных радикалов, ведущих цепи окисления. Интенсивность хемилюминесценции при цепном окислении (пероксидации) липидов равна скорости образования фотонов в реакции:
| LOO· + LOO· -> молекулярные продукты + фотон |
Скорость самой реакции (т.е. число молей продукта, образующегося в секунду) по закону действующих масс равна:
| n=k · [LOO·]2, |
где k – константа скорости реакции взаимодействия радикалов. Следовательно, интенсивность свечения (в числе молей фотонов в секунду) равна:
| JХЛ = QХЛ · k · [LOO·]2, |
где QХЛ – квантовый выход хемилюминесценции.
Таким образом, интенсивность свечения однозначно отражает концентрацию свободных радикалов, ведущих цепи окисления липидов, в каждый данный момент времени, что представляет собой бесценную информацию для анализа механизма реакций на основе измерений кинетики (т.е. временного хода) хемилюминесценции.
Различают несколько стадий процесса, каждая из которых определяется определенными реакциями цепного процесса пероксидации:
FF – быстрая вспышка ХЛ,
LP – латентный период,
SF – медленная вспышка ХЛ,
SL – стационарное свечение.
Математический анализ такого рода кинетических кривых лежит в основе изучения механизма цепных реакций окисления, которые отличаются большой сложностью. С развитием техники измерения очень слабых световых потоков стало ясно, что свечение при химических реакциях (хемилюминесценция) – не такая уж экзотика. Слабое свечение сопровождает по существу все химические реакции, идущие с участием свободных радикалов.
Собственное свечение животных клеток и тканей обусловлено преимущественно реакциями цепного окисления липидов и реакциями, сопровождающими взаимодействие окиси азота и супероксидного радикала. В присутствии определенных соединений, обычно называемых в отечественной литературе "активаторами", свечение клеток и тканей может быть усилено на несколько порядков величины. Свечение отражает процессы, скорее вредные для организма: в его основе лежат реакции радикалов, которые обладают способностью разрушать клеточные структуры и приводить к развитию болезней человека, т. к. связано с выделением большого количества энергии в химической реакции, в которую вступают очень реакционноспособные частицы – свободные радикалы.
Но именно в силу высокой химический активности эти же радикалы способны повреждать молекулы и клетки. По этой причине за последние годы исследование хемилюминесценции, сопровождающей биохимические реакции в живых клеток, сместилось из области "чистой" биологии в область медицины.
В развитии многих патологических состояний в нашем организме принимают непосредственное участие свободные радикалы кислорода, липидов и белков, а также реакции радикалов с окисью азота. Все эти реакции сопровождаются хемилюминесценцией, изучение которой помогает вникнуть в механизм этих реакций, а значит – поможет понять, как их контролировать.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 649; Нарушение авторских прав?; Мы поможем в написании вашей работы!