
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ковалентная связь обладает свойствами насыщаемости, направленности и поляризуемости. Разберем эти свойства
|
|
|
|
Длина химической связи - это расстояние между центрами атомов, образующих химическую связь между собой, т.е. расстояние между ядрами двух атомов. Длина связи зависит от природы атомов, образующих между собой связь и от кратности связи между атомами. Как правило, с увеличением энергии связи длина связи уменьшается (в однотипных соединениях), с увеличением кратности связи длина связи уменьшается.
Н – Н (0,74×10-10 м); º С – С º (1,54×10-10 м);
= С = С = (1,34×10-10м); – С º С – (1,20×10-10м).
σ - и π- связи.
Химическая связь образуется при перекрывании электронных облаков атомов, причем это перекрывание может происходить разными способами.

|

|
 |
Если перекрывание электронных облаков (атомных орбиталей) происходит по общей линии, соединяющей центры двух атомов, то образуется σ - связь, например (рис. 11).
Рисунок 11. Образование σ - связи.

|
Если перекрывание атомных орбиталей (электронных облаков) происходит по обе стороны от линии, соединяющей центры атомов (т.е. вверху и внизу от этой линии), то образуется p- связь (рис. 12).
Рисунок 12. Образование p- связи.
Для образования химической связи (σ- или p - связи) необходимо, чтобы волновые функции ψ в месте перекрывания имели одинаковый знак (или обе с плюсом, или обе с минусом).
Отметим, что s-электронные облака образуют только σ- связи, а р- и d- электронные облака могут при перекрывании образовывать как σ-, так и p-связи.
Кратность или порядок связи - это есть число связей между двумя атомами в молекуле. Кратность связи может выражаться целыми и дробными числами: 1, 2, 1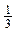 и т.д. Молекул, в которых кратность связи больше единицы, много. Например, в молекуле N2 содержится тройная связь, т.е. кратность связи равна трем, причем одна связь σ -типа и две другие связи π - типа: N ≡ N. С увеличением кратности связи, как правило, энергия связи увеличивается, а длина связи уменьшается.
и т.д. Молекул, в которых кратность связи больше единицы, много. Например, в молекуле N2 содержится тройная связь, т.е. кратность связи равна трем, причем одна связь σ -типа и две другие связи π - типа: N ≡ N. С увеличением кратности связи, как правило, энергия связи увеличивается, а длина связи уменьшается.
|
|
|
2. Основные положения метода валентных связей.
Для объяснения образования химической связи применяются 2 метода:
1) метод валентных связей (ВС);
2) метод молекулярных орбиталей (МО).
Метод ВС исходит из положения, что каждая пара атомов (два атома) в молекуле образуют между собой связь при помощи общих электронных пар.
1) Ковалентная связь образуется при помощи общих электронных пар, образованных из атомов, имеющих неспаренные электроны с противоположно направленными спинами.
2)Ковалентная связь тем прочнее, чем больше степень перекрывания электронных облаков.
3) Ковалентная связь образуется в направлении максимального перекрывания электронных облаков (тогда образуется самая прочная связь).
Таким образом, химическая связь образуется по методу ВС за счет общей пары электронов и эта связь локализована (расположена) между двумя атомами, т.е. она двухэлектронная и двухцентровая. Поэтому метод ВС еще называется методом локализованных электронных пар (ЛЭП).
Насыщаемость ковалентной связи – это есть число ковалентных связей, которые способен образовать данный атом с другими атомами. Она определяется природой атома и его валентной структурой. Благодаря насыщаемости связи молекулы имеют определенный состав (Н2О, НСl, H3N, H2S и др.).
Разберем это свойство для некоторых атомов.
1) Возьмем атом водорода Н, у которого на 1S-орбитали находится один неспаренный валентный электрон (↑), за счет которого атом Н может образовать одну ковалентную связь, т.е. ковалентность будет равна 1
(Н –Н, Н – Сl).
2) Возьмем атом углерода. Его электронная формула 1s22s22p2, а электронно-структурная схема валентного уровня будет:
|
|
|
│ ↑ │ ↑ │ │
│↑↓│ 2р
2s
т.е. имеет 2 неспаренных электрона, за счет которых может образовать 2 ковалентные связи. Но для углерода (С) характерно образование четырех ковалентных связей. Поэтому атом «С» переходит в возбужденное состояние, т.е. один из двух 2s-электронов переходит на свободную орбиталь 2р-подуровня и тогда станет 4 неспаренных электрона, за счет которых атом С может образовать 4 ковалентные связи, т.е. ковалентность будет равна 4 (СН4, СО2 и др.).
│ ↑ │ ↑ │ │ возбуждение │ ↑ │ ↑ │ ↑ │
 |
│↑↓│ │ ↑ │ 2р
2s 2s
Таким образом, максимальная ковалентность атома углерода равна числу валентных орбителей и равна 4.
3) Возьмем атом азота, у которого на 4 валентных орбиталях находятся 5 валентных электрона, три из которых неспаренные:
│ ↑ │ ↑ │ ↑ │
│↑↓│ 2р
2s
За счет трех неспаренных электронов атом N образует 3 ковалентные связи с тремя атомами водорода, у которых по одному неспаренному электрону, при этом образуется молекула NH3:
 N │ ↑ │ ↑ │ ↑ │
N │ ↑ │ ↑ │ ↑ │
│↑↓│ ò ò ò NH3
│ ↓ │ ↓ │ ↓ │
Н Н Н
Кроме того, у атома N осталась еще неподеленная электронная пара, поэтому за счет этой пары электронов азот может образовать с ионом Н+ еще одну (четвертую) ковалентную связь. При этом на образование этой связи атом азота отдаст два электрона (электронную пару), а ион водорода (□Н+) примет эту пару электронов на свою свободную валентную орбиталь. Такая ковалентная связь называется донорно-акцепторной связью, причем азот будет называться донором электронной пары, а ион Н+ называется акцептором электронной пары.
Таким образом, атом N в итоге образовал 4 ковалентные связи: три из них за счет 3 неспаренных электронов и одну связь - по донорно-акцепторному механизму.
 │ ↑ │ ↑ │ ↑ │ В итоге получили ион аммония
│ ↑ │ ↑ │ ↑ │ В итоге получили ион аммония
│↑↓│ NH+4, в котором ковалентность
NH+4 ↓ азота равна 4.
│ ││ ↓ │ ↓ │ ↓ │
Н+ Н Н Н
Таким образом, максимальная ковалентность атома азота равна числу его валентных орбиталей и равна 4.
Ковалентная связь обладает свойством направленности. Орбитали р- и d-типа направлены по координатным осям. В соответствии с направленностью атомных орбиталей происходит и их перекрывание при образовании ковалентной связи, поэтому и ковалентная связь обладает свойством направленности.
|
|
|
Пример 1. Н – Сl При образовании молекулы НСl образуется ковалентнаясвязь при перекрывании s-электронного облака атома Н и р - электронного облака атома хлора, образуется линейная молекула:
Пример 2. Рассмотрим молекулу Н2S. У атома серы два неспаренных р-электрона. В молекуле Н2S образуется две σ- связи за счет перекрывания р-орбиталей атома серы, на которых расположены неспаренные электроны, с s – электронными облаками двух атомов Н. Так как р-орбитали атома серы расположены под углом 90о относительно друг друга, то и валентный угол (это угол между двумя ковалентными связями) тоже должен быть равен 90о. Однако он равен 92о. Это можно объяснить отталкиванием одноименных зарядов δ+ двух атомов Н (т.к. связь S-Н полярна), поэтому валентный угол увеличивается с 90о до 92о. Направленность ковалентной связи зависит также от типа гибридизации валентных орбиталей атома (см. ниже).
3. Гибридизация атомных орбиталей.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1058; Нарушение авторских прав?; Мы поможем в написании вашей работы!