
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 11. Скорость химических реакций
|
|
|
|
Изменение энергии Гиббса химической реакции (DG°298 реакции) равно сумме энергий Гиббса образования продуктов реакции минус сумма энергий Гиббса образования исходных веществ (с учетом коэффициентов в уравнении реакции).
Изменение энтальпии реакции равно сумме энтальпий сгорания исходных веществ минус сумма энтальпий сгорания продуктов реакции (при этом учитываются коэффициенты в уравнении реакции).
Например, для реакции аА + bВ ® dD + еЕ получаем:
DН°298 р-ции = (аDН°298 сгор. (А) + bDН°298 сгор. (В)) – (d×DН°298 сгор. (D) + +е×DН°298 сгор. (Е)).
Вычислим тепловой эффект реакции нейтрализации 1 моля эквивалента кислоты 1 молем эквивалента основания.
Если взять сильную кислоту HCl и сильное основание NaOH, то уравнение реакции нейтрализации имеет вид:
HCl + NaOH = NaCl + H2O + Qнейтр.
В ионной форме:
H+ + Cl- + Na+ + OH- ® Na+ + Cl- + H2O или
H+ + OH- ® H2O + 57,22кДж/моль×экв.
Таким образом, реакция нейтрализации сильной кислоты и сильного основания сводится к образованию H2O из ионов H+ и OH- и тепловой эффект этой реакции постоянный и равен 57,22кДж/моль×экв., а изменение энтальпии DН°298 = - 57,22кДж/моль×экв.
Таким образом, энтальпия нейтрализации сильных кислот и сильных оснований (рассчитанная на 1 моль эквивалента кислоты и основания) постоянная и равна DН°298 = - 57,22кДж/моль×экв. (или – 13,75ккал/моль×экв.).
При нейтрализации слабых кислот (Н2СО3, Н2S, HCN и др.) и слабых оснований (NH3 и др.) энтальпия нейтрализации меньше (по абсолютной величине), так как при этом затрачивается энергия на ионизацию кислоты или основания.
2. Энтропия системы. Уравнение Больцмана
Энтропия есть мера неупорядоченности (беспорядка) системы. Чем больше беспорядок системы, тем больше численное значение энтропии, а значит, это состояние системы будет наиболее вероятным. Поэтому, все процессы, связанные с увеличением беспорядка в системе, сопровождаются возрастанием энтропии: расширение газа, растворение твердых веществ в жидкости, плавление твердого вещества, кипение жидкости. И, наоборот, все процессы, связанные с увеличением в системе упорядоченности (т.е. уменьшением беспорядоченности) сопровождаются уменьшением энтропии: охлаждение газа, сжатие газа, кристаллизация и др.
|
|
|
Энтропия рассчитывается по уравнению Больцмана:
S = K×lnW,
где S – энтропия системы;
К – постоянная Больцмана (К = R/N0, где R – газовая постоянная, а N0 – число Авагадро);
W – вероятность состояния системы (W обычно имеет очень большие значения).
Энтропия имеет размерность энергии, деленной на температуру, и обычно она относится к 1 молю вещества, поэтому выражается в Дж/моль×К. В справочниках приведены стандартные энтропии веществ, то есть при 298К и давлении 1 атм. или 1,013×105 Па (обозначается S°298). Энтропия простых веществ (Н2, О2 и др.) не равна нулю и тоже приводится в справочниках.
Отметим, что энтропия вещества в газообразном состоянии значительно больше, чем в жидком состоянии, а в жидком состоянии больше, чем в твердом состоянии (во всех случаях берем 1моль данного вещества). Например,

Изменение энтропии реакции ( DS°298 реакции) равно сумме энтропий продуктов реакции минус сумма энтропий исходных веществ (с учетом коэффициентов в уравнении реакции).
Например, для реакции аА + bВ ® dD + еЕ получаем:
DS°298 реакции = (d×DS°298 (D) + e×DS°298 (E)) - (a×DS°298 (A) + b×DS°298 (B)).
Стандартные энтропии веществ S°298 (D), S°298 (E ) и так далее находят в справочниках.
3. Энергия Гиббса. Направления химических реакций
Для определения возможности и направления протекания химической реакции существуют два фактора: энтальпийный фактор (DН) и энтропийный фактор (DS). Если изменение энтальпии химической реакции DН<0, то энтальпийный фактор способствует самопроизвольному протеканию реакции в прямом направлении, то есть слева направо (®), а если DН>0, то энтальпийный фактор способствует протеканию реакции в обратном направлении (¬).
|
|
|
Если изменение энтропии химической реакции ∆S > 0, то энтропийный фактор способствует самопроизвольному протеканию реакции в прямом направлении (→), а если ∆S < 0, то энтропийный фактор способствует протеканию реакции в обратном направлении (←).
Влияние обоих факторов (то есть DН и DS) на направление протекания химических реакций учитывает изменение энергии Гиббса DG, которое равно:
DG = DН - ТDS,
где DG – изменение энергии Гиббса химической реакции;
DН и DS – это изменение энтальпии и энтропии химической реакции;
Т – температура в °К.
Изменение энергии Гиббса DG служит критерием самопроизволь-ного протекания изобарно-изотермических реакций (то есть реакций при постоянной температуре и постоянном давлении), а именно:
При постоянстве температуры и давления химические реакции могут самопроизвольно протекать только в таком направлении, при котором энергия Гиббса уменьшается, то есть изменение энергии Гиббса реакции DG<0.
1) Если DG < 0, то реакция возможна в прямом направлении (®).
2) Если DG > 0, то реакция возможна в обратном направлении (¬).
3) Если DG = 0, то наступило состояние термодинамического равновесия.
Таким образом, чтобы определить направление реакции, надо рассчитать изменение энергии Гиббса этой реакции (DG реакции). Для расчета DG реакции используются энергии Гиббса образования веществ при стандартных условиях DG°298, которые приводятся в справочниках.
Энергия Гиббса образования вещества – это изменение энергии Гиббса в реакции образования одного моля вещества из простых веществ. Обозначается DG°298 и относится к 1 молю вещества при стандартных условиях; обычно выражается в кДж/моль. При этом для простых веществ DG°298 равно нулю.
Например, для реакции:
аА + bВ ® dD + еЕ
DG°298 реакции = (d×DG°298 (D) + e×DG°298 (E)) - (a×DG°298 (A) + b×DG°298 (B)).
Изменение энергии Гиббса реакции можно рассчитать также, определив изменение энтальпии реакции (DН реакции) и изменение энтропии реакции (DS реакции), то есть
|
|
|
DG реакции = DН реакции - Т×DS реакции.
Пример. Рассчитать при 298К изменение энтальпии, энтропии и изменение энергии Гиббса реакции 2NO2 «N2O4, если даны энтальпии образования и энтропии веществ, участвующих в данной реакции.
| Вещество | DН°298 обр., кДж/моль | S°298, Дж/моль×К |
| NO2 | 33,5 | 240,2 |
| N2O4 | 9,6 | 303,8 |
DН°298 реакции = DН°298 обр. (N2O4) - 2×DН°298 обр. (NO2) = 9,6 - 2×33,5 =
= - 57,4 кДж (- 57400 Дж);
DS°298 реакции = S°298 (N2O4) - 2×S°298 (NO2) = 303,8 - 2×240,2 = - 176,6 Дж/К;
DG°298 реакции = DН°298 реакции - Т×DS°298 реакции =
= - 57400 Дж – 298К×(- 176,6 Дж/К) = - 4773,2 Дж.
Так как DG°298 реакции < 0, то при 298К данная реакция возможна в прямом направлении.
1. Основные понятия химической кинетики.
2. Зависимость скорости реакции от концентрации веществ.
3. Зависимость скорости реакции от температуры. Энергия активации.
1. Основные понятия химической кинетики
Реакции бывают гомогенные и гетерогенные.
Гомогенная реакция – это реакция, протекающая в пределах одной фазы. Примером гомогенной реакции является любая реакция, протекающая в растворе (например, реакция нейтрализации между кислотой и щелочью), и когда все компоненты находятся в газообразном состоянии.
Например, 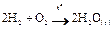
Гомогенная реакция протекает во всем объеме системы и ее скорость зависит от объема системы.
Гетерогенная реакция – это реакция, протекающая на поверхности раздела фаз, то есть когда реагирующие вещества находятся в разных агрегатных состояниях или же любая реакция, протекающая на поверхности твердого катализатора. Например,


Скорость гетерогенной реакции зависит от площади поверхности раздела фаз.
Скоростью химической реакции называется число актов химического взаимодействия, происходящих в единицу времени в единице объема системы (это для гомогенных реакций) или на единице поверхности раздела фаз (это для гетерогенных реакций):
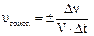 и
и
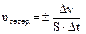 ,
,
где Dn - изменение числа молей исходного вещества или продукта реакции за время Dt;
V – объем гомогенной системы;
S – площадь поверхности раздела фаз для гетерогенной системы.
|
|
|
В случае гомогенной реакции 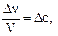 поэтому
поэтому 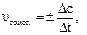 то есть скорость гомогенной реакции равна изменению концентрации (Dс) исходного вещества или продукта реакции в единицу времени (Dt).
то есть скорость гомогенной реакции равна изменению концентрации (Dс) исходного вещества или продукта реакции в единицу времени (Dt).
Есть средняя и мгновенная скорости реакции.
Средняя скорость реакции, равная 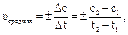 это скорость реакции за данный промежуток времени Dt = t2 - t1 и ее значение зависит от промежутка времени Dt. Чем меньше значение Dt, тем точнее определена средняя скорость.
это скорость реакции за данный промежуток времени Dt = t2 - t1 и ее значение зависит от промежутка времени Dt. Чем меньше значение Dt, тем точнее определена средняя скорость.
Мгновенная или истинная скорость реакции – это скорость реакции в данный момент времени, когда Dt стремится к нулю, то есть:
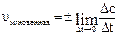 или
или 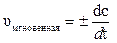
Химические реакции по сложности делятся на простые и сложные.
Простые реакции – это реакции, протекающие в одну стадию. Они еще называются одностадийными, элементарными или изолированными реакциями. Уравнение этой стадии совпадает с уравнением реакции в целом.
Примеры простых реакций:
2NO + O2 ® 2NO2
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 914; Нарушение авторских прав?; Мы поможем в написании вашей работы!