
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
А + К ® АК
|
|
|
|
Увеличение концентрации исходных веществ (H2 или N2) будет смещать равновесие вправо (®), а при уменьшении концентрации этих веществ - влево (¬). При увеличении концентрации продукта реакции (NH3) равновесие смещается влево (¬), а при уменьшении концентрации NH3 - вправо (®).
3. Энергия активации каталитических реакций и сущность действия катализатора
Для изменения скорости реакций используют катализаторы.
Катализатор - это вещество, которое изменяет (увеличивает или уменьшает) скорость реакции, участвуя в ней, но остающееся после реакции в неизменном состоянии и количестве.
Катализатор считается положительным, если он увеличивает скорость реакции, и отрицательным, если катализатор уменьшает скорость реакции. В качестве катализатора могут быть металлы, оксиды, основания, кислоты, соли, стенки реакционного сосуда и т.д.
В случае гомогенного катализа реагирующие вещества и катализатор образуют одну фазу (газ или раствор), при этом катализатор равномерно распределен в реакционном объеме. Например, пары воды (катализатор) ускоряют реакцию окисления СО:
2СО + О2  2СО2
2СО2
В случае гетерогенного катализа катализатор и реагирующие вещества находятся в разных агрегатных состояниях. Например
С2Н4(г) + Н2 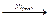 С2Н6(г).
С2Н6(г).
В этом случае реакция протекает на поверхности твердого катализатора (никеля).
Рассмотрим реакцию А + В ® АВ (без катализатора).
В присутствии катализатора (К) реакция идет по другому: в этом случае катализатор сначала реагирует с исходным веществом А (или с веществом В), образуя с ним промежуточное реакционноспособное соединение АК, которое, взаимодействуя с другим исходным веществом В, образует продукт реакции АВ, выделяя при этом катализатор в прежнем виде:
|
|
|
АК + В ® АВ + К
Складывая эти два уравнения, получаем А + В ® АВ, то есть катализатор выделяется в свободном виде и в неизменном количестве.
В большинстве случаев действие катализатора объясняется тем, что он уменьшает энергию активации реакции. Так как энергия активации понижается, то некоторые неактивные молекулы, энергия которых была недостаточна для химического взаимодействия, теперь становятся активными, поэтому скорость реакции увеличивается.
Следует отметить, что катализатор не смещает химическое равновесие обратимой реакции, так как в одинаковой степени увеличивает скорость как прямой, так и обратной реакций, поэтому состояние химического равновесия не нарушается и выход продуктов реакции не изменяется. Катализатор лишь ускоряет наступление химического равновесия.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 438; Нарушение авторских прав?; Мы поможем в написании вашей работы!