
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Біохімічних процесів
ЗАКОНОМІРНОСТІ ПЕРЕБІГУ
ТЕРМОДИНАМІЧНІ Й КІНЕТИЧНІ
Зміщення КОС крові у напрямку підвищення концентрації іонів Гідрогену називається ацидозом, а в напрямку зниження їх концентрації – алкалозом.
ПРЕДМЕТ ХІМІЧНОЇ ТЕРМОДИНАМІКИ. ОСНОВНІ ПОНЯТТЯ ХІМІЧНОЇ ТЕРМОДИНАМІКИ: ТЕРМОДИНАМІЧНА СИСТЕМА (ІЗОЛЬОВАНА, ЗАКРИТА, ВІДКРИТА, ГОМОГЕННА, ГЕТЕРОГЕННА), ПАРАМЕТРИ СТАНУ (ЕКСТЕНСИВНІ, ІНТЕНСИВНІ), ТЕРМОДИНАМІЧНИЙ ПРОЦЕС.
Об'єктом дослідження термодинаміки є термодинамічна система — сукупність тіл, які взаємодіють між собою та оточенням. Термодинамічна система називається закритою або відкритою, в залежності від того, чи вона може обмінюватися речовиною з навколишніми тілами. Якщо система не може обмінюватися з навколишніми тілами ні речовиною, ні енергією, то вона називається ізольованою.
Рівноважна термодинаміка вивчає термодинамічні системи в стані термодинамічної рівноваги. В такому стані систему можна охарактеризувати параметром, який називається температурою. В рівноважному стані температура однакова для усіх частин термодинамічної системи, а у випадку неізольованої термодинамічної системи вона збігається з температурою навколишніх тіл, які в термодинаміці називають термостатом. Існування рівноважного стану часто називають нульовим законом термодинаміки.
Кожна рівноважна термодинамічна система характеризується набором термодинамічних змінних (параметрів): об'ємом, тиском, хімічним складом, температурою, ентропією, хімічними потенціалами та іншими. Не всі з цих параметрів є незалежними. В рівноважному стані їхні значення зв'язані між собою рівняннями стану.
Рівняння стану визначається експериментально для реальних систем або розраховується за допомогою методів статистичної фізики для модельних систем.
Рівноважна термодинаміка розглядає тільки зворотні процеси, які відбуваються достатньо повільно, щоб стан термодинамічної системи можна було б вважати рівноважним у будь-який момент часу.
ПЕРШИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНТАЛЬПІЯ. ТЕРМОХІМІЧНІ РІВНЯННЯ. СТАНДАРТНІ ТЕПЛОТИ УТВОРЕННЯ ТА ЗГОРЯННЯ. ЗАКОН ГЕССА.
Перший початок можна сформулювати в декількох видах:
1. Неможливе виникнення і знищення енергії
2. Будь-яка форма руху здатна і повинна перетворюватися на будь-яку іншу форму рухує
3. Внутрішня енергія є однозначною формою стану
4.Вічний двигун першого роду неможливий
5. Нескінченна мала зміна внутрішній енергії є повним диференціалом.
6. Сума кількості теплоти і роботи не залежить від шляху процесу.
Перший закон термодинаміки, постулювавши закон збереження
енергії для термодинамічної системи. не указує спрямування процесів, що відбуваються в природі. Спрямування термодинамічних процесів встановлює другий початок термодинаміки.
Зако́н Ге́сса — тепловий ефект реакції при постійних об'ємі або тиску (коли відсутня не пов'язана з розширенням робота) не залежить від шляху реакції, а лише від початкового й кінцевого станів системи.
Закон Гесса справедливий оскільки ентальпія є функцією стану системи й не залежить від того, яким чином ця система утворилася.

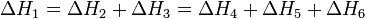
Наслідки:
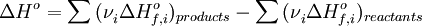

ДРУГИЙ ЗАКОН ТЕРМОДИНАМІКИ. ЕНТРОПІЯ.
ВІЛЬНА ЕНЕРГІЯ ГІББСА.
КРИТЕРІЇ САМОЧИННОГО ПЕРЕБІГУ ХІМІЧНИХ ПРОЦЕСІВ.
Дру́гий закон термодина́міки — один із основних законів фізики, закон про неспаданняентропії в ізольованій системі. Він накладає обмеження на кількість корисної роботи, яку може здійснити тепловий двигун. На засадничому рівні другий закон термодинаміки визначає напрямок протікання процесів у фізичній системі - від порядку до безпорядку. Існує багато різних формулювань другого закону термодинаміки, загалом еквівалентних між собою.
Для системи із сталою температурою існує певна функція стану S — ентропія, яка визначається таким чином, що
1. Адіабатичний перехід із рівноважного стану A в рівноважний стан B можливий лише тоді, коли
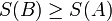 .
.
2. Приріст ентропії у квазістаціонарному процесі дорівнює
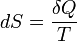 ,
,
де T — температура.
"Ентропія ізольованої системи не може зменшуватися" (закон неубиванія ентропії).
Вільна енергія Гіббса (або просто енергія Гіббса, або потенціал Гіббса, або термодинамічний потенціалу вузькому сенсі) - це величина, що показує зміну енергії в ході хімічної реакції і дає таким чином відповідь на принципову можливість протікання хімічної реакції; це термодинамічний потенціал такого вигляду:
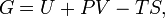
Енергію Гіббса можна розуміти як повну хімічну енергію системи
У хімічних процесах одночасно діють два протилежних фактора - ентропійний (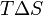 ) І ентальпійний (
) І ентальпійний (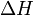 ). Сумарний ефект цих протилежних факторів у процесах, що протікають при постійному тиску і температурі, визначає зміна енергії Гіббса (
). Сумарний ефект цих протилежних факторів у процесах, що протікають при постійному тиску і температурі, визначає зміна енергії Гіббса (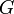 ):
):

З цього виразу випливає, що  , Тобто деякий кількість теплоти витрачається на збільшення ентропії (
, Тобто деякий кількість теплоти витрачається на збільшення ентропії (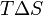 ), Ця частина енергії втрачена для здійснення корисної роботи, її часто називають пов'язаної енергією. Інша частина теплоти (
), Ця частина енергії втрачена для здійснення корисної роботи, її часто називають пов'язаної енергією. Інша частина теплоти ( ) Може бути використана для здійснення роботи, тому енергію Гіббса часто називають також вільною енергією.
) Може бути використана для здійснення роботи, тому енергію Гіббса часто називають також вільною енергією.
Характер зміни енергії Гіббса дозволяє судити про принципову можливість здійснення процесу. При  процес може протікати, при
процес може протікати, при  процес протікати не може (іншими словами, якщо енергія Гіббса в початковому стані системи більше, ніж в кінцевому, то процес принципово може протікати, якщо навпаки - то не може). Якщо ж
процес протікати не може (іншими словами, якщо енергія Гіббса в початковому стані системи більше, ніж в кінцевому, то процес принципово може протікати, якщо навпаки - то не може). Якщо ж  , То система знаходиться в стані хімічної рівноваги.
, То система знаходиться в стані хімічної рівноваги.
Зверніть увагу, що мова йде виключно про принципову можливість протікання реакції. В реальних же умовах реакція може не починатися і при дотриманні нерівності  (По кінетичним причин).
(По кінетичним причин).
Існує корисне співвідношення, що зв'язує зміна вільної енергії Гіббса  в ході хімічної реакції з її константою рівноваги
в ході хімічної реакції з її константою рівноваги 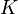 :
:

Взагалі кажучи, будь-яка реакція може бути розглянута як оборотна (навіть якщо на практиці вона такою не є). При цьому константа рівноваги визначається як
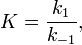
де 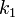 - константа швидкості прямої реакції,
- константа швидкості прямої реакції, 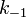 - Константа швидкості зворотної реакції.
- Константа швидкості зворотної реакції.
ЗАСТОСУВАННЯ ОСНОВНИХ ПОЛОЖЕНЬ ТЕРМОДИНАМІКИ ДО ЖИВИХ ОРГАНІЗМІВ. АТФ ЯК ДЖЕРЕЛО ЕНЕРГІЇ ДЛЯ БІОХІМІЧНИХ РЕАКЦІЙ. МАКРОЕРГІЧНІ СПОЛУКИ.
Живі організми високоорганізовані, тому їх ентропія невелика. Вони зберігають цей низькоентропійний стан за рахунок підвищення ентропії зовнішнього середовища.
Основне рівняння, яке зв'язує ентальпію, вільну енергію й ентропію, має вигляд: G = Н – Т •S. Зміна вільної енергії у ході реакції А ® В при постійних температурах і тиску виражається формулою
Ця величина служить для оцінки напрямку перебігу реакцій. Якщо ∆G від'ємна, то вільна енергія, що міститься в речовині В, менша, ніж вільна енергія речовини А, тобто вільна енергія зменшується, виділяється в ході реакції. Такі реакції можуть перебігати самовільно і називаються екзергонічними. Вони термодинамічно вигідні, бо здійснюється перехід від нестійкого стану з високою хімічною енергією до більш стійкого стану з меншою хімічною енергією. І навпаки, якщо ∆G – додатна величина, тобто вільна енергія зростає (у речовині В більша, ніж у А), то реакція не може відбуватися без використання енергії ззовні, і таку реакцію називають ендергонічною. Ендергонічні реакції можуть бути здійснені тільки при поєднанні з екзергонічними реакціями. Для такого поєднання необхідно, щоб обидві реакції мали якусь спільну проміжну сполуку. Найчастіше зв’язувальним агентом виступає АТФ. Якщо б екзергонічні реакції перебігали самі по собі, то хімічна енергія, що звільняється, втрачалась би у вигляді теплової. Тому в живому організмі з екзергонічними реакціями окиснення органічних речовин у процесі катаболізму спряжені реакції ендергонічні, синтезу АТФ із АДФ і неорганічного фосфату (рис.):
У свою чергу енергія гідролізу АТФ використовується клітинами для виконання всіх відомих ендергонічних процесів:
1) реакцій синтезу вуглеводів, ліпідів, білків, нуклеїнових кислот;
2) механічної роботи, наприклад скорочення м'язів, руху хромосом при мітозі;
3) активного перенесення речовин через мембрани проти градієнта концентрації;
4) забезпечення точної передачі генетичної інформації;
5) електричної роботи – проведення нервового імпульсу.
Отже, АТФ виступає як переносник хімічної енергії, який зв'язує клітинні процеси, що супроводжуються виділенням енергії, з тими головними видами клітинної активності, в яких енергія споживається.
МАКРОЕРГІЧНІ СПОЛУКИ
АТФ відноситься до сполук, що містять макроергічні зв'язки, тобто багаті енергією. Зазначимо відмінність поняття “багатий енергією зв'язок" у біохімії від поняття “енергія зв'язку" у хімії. Під останнім поняттям у хімії розуміють енергію, необхідну для розриву зв'язку між двома атомами в молекулі (для розриву макроергічних зв'язків також потрібно затратити енергію). Розглядаючи в біохімії високоенергетичні та низькоенергетичні зв'язки і сполуки, енергію зв'язку визначають як вільну енергію, що виділяється при гідролітичному розпаді даної сполуки.
У реакції АТФ + Н2О ® АДФ + ФН зміна вільної енергії дорівнює 34,5 кДж/моль.
Зв'язок вважається високоенергетичним, якщо при гідролізі його звільняється більше 21 кДж (за іншими джерелами – 30 кДж/моль). Таким чином, у молекулі АТФ є два макроергічних зв'язки, які характеризуються величиною вільної енергії 28-37 кДж/моль. Макроергічний зв'язок містить і АДФ, але при його гідролізі до АМФ і ФН енергія вилучається у вигляді тепла.
Рівноцінні з АТФ інші нуклеозидтрифосфати (ГТФ, УТФ, ЦТФ, ТТФ).
ХІМІЧНА КІНЕТИКА ЯК ОСНОВА ДЛЯ ВИВЧЕННЯ ШВИДКОСТЕЙ ТА МЕХАНІЗМУ БІОХІМІЧНИХ РЕАКЦІЙ.
ШВИДКІСТЬ РЕАКЦІЇ. ЗАЛЕЖНІСТЬ ШВИДКОСТІ РЕАКЦІЇ ВІД КОНЦЕНТРАЦІЇ.
ЗАКОН ДІЇ МАС І ШВИДКІСТЬ РЕАКЦІЇ.
КОНСТАНТА ШВИДКОСТІ РЕАКЦІЇ. ПОНЯТТЯ ПРО ПОРЯДОК І МОЛЕКУЛЯРНІСТЬ РЕАКЦІЇ.
Швидкість хімічної реакції - зміна кількості одного з реагуючих речовин за одиницю часу в одиниці реакційного простору. Є ключовим поняттям хімічної кінетики. Швидкість хімічної реакції - величина завжди позитивна, тому, якщо вона визначається по вихідному речовині (концентрація якого убуває в процесі реакції), то отримане значення домножается на -1.
Наприклад для реакції:

вираз для швидкості буде виглядати так:
 .
.
У 1865 році Н. Н. Бекетовим і в 1867 році Гульдбергом і Вааге був сформульований закон діючих мас:
Швидкість хімічної реакції в кожен момент часу пропорційна концентрацій реагентів, зведеним до деяких ступеня.
υ = k [A] а * [B] b,
для реакції aA + bB = cC + dD,
де υ - швидкість хімічної реакції;
[А] - концентрація речовини А;
[В] - концентрація речовини В;
k - константа швидкості реакції (коефіцієнт пропорційності);
а і b - коефіцієнти в рівнянні реакції.
Якщо [А] = [В] = 1 моль / л, то швидкість хімічної реакції (υ) дорівнює константі (k). Константа швидкості реакції залежить від природи реагуючих речовин, температури, але не залежить від концентрації речовини.
Для елементарних реакцій показник ступеня при значенні концентрації кожної речовини часто дорівнює його стехиометрическому коефіцієнту, для складних реакцій це правило не дотримується.
Крім концентрації на швидкість хімічної реакції впливають такі чинники:
· природа реагуючих речовин,
· наявність каталізатора,
· температура (правило Вант-Гоффа),
· тиск,
· площа поверхні реагуючих речовин.
ЗАЛЕЖНІСТЬ ШВИДКОСТІ РЕАКЦІЇ ВІД ТЕМПЕРАТУРИ.
ПРАВИЛО ВАНТ-ГОФФА.
З підвищенням температури збільшується число активних молекул, тому збільшується швидкість реакції.
Залежність швидкості хімічної реакції від температури визначається правилом Вант-Гоффа: при підвищенні температури на 10 о С швидкість більшості хімічних реакцій збільшується у 2-4 рази. Це правило математичновиражається наступною формулою:

де γ - температурний коефіцієнт, який показує, у скільки разів збільшується швидкість реакції при підвищенні температури на 10 о С.
ЕНЕРГІЯ АКТИВАЦІЇ. РІВНЯННЯ АРРЕНІУСА.
ПОНЯТТЯ ПРО ТЕОРІЮ ПЕРЕХІДНОГО СТАНУ (АКТИВОВАНОГО КОМПЛЕКСУ).
Енергія активації - характерний параметр процесів, зокрема хімічних реакцій, кінетика яких описується рівнянням Арреніуса.
 ,
,
де 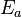 - енергія активації, R - газова стала, T - температура, A - певний передекспоненційний множник, який слабо залежить від температури.
- енергія активації, R - газова стала, T - температура, A - певний передекспоненційний множник, який слабо залежить від температури.
Енергія активації описує потенціальний бар'єр, який повинні подолати частинки для того, щоб реакція відбулася. При підвищенні температури, доля частинок із кінетичною енергією, достатньою для подолання бар'єру збільшується.
Енергія активації вимірюється зазвичай у кДж/моль або ккал/моль.
В фізиці закон Арреніуса частіше записують у вигляді
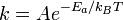 ,
,
де  - стала Больцмана. При такому записі енергія активації записується в розрахунку на одну частинку і має розмірністьенергії. Найчастіше її значення приводиться в електронвольтах.
- стала Больцмана. При такому записі енергія активації записується в розрахунку на одну частинку і має розмірністьенергії. Найчастіше її значення приводиться в електронвольтах.
Активаційний закон і енергію активації запровадив шведський вчений Сванте Арреніус в 1889 році.
КАТАЛІЗ І КАТАЛІЗАТОРИ. ОСОБЛИВОСТІ ДІЇ КАТАЛІЗАТОРІВ. ГОМОГЕННИЙ ТА ГЕТЕРОГЕННИЙ КАТАЛІЗ. КИСЛОТНО-ОСНОВНИЙ КАТАЛІЗ. МЕХАНІЗМ ДІЇ КАТАЛІЗАТОРІВ. ПРОМОТОРИ ТА КАТАЛІТИЧНІ ОТРУТИ.
|
|
Дата добавления: 2014-01-07; Просмотров: 4963; Нарушение авторских прав?; Мы поможем в написании вашей работы!