
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Різниця потенціалів (стрибок потенціалу), що виникає на межі поділу електрод — розчин, - називається електродним потенціалом
|
|
|
|
ЇХ БІОЛОГІЧНА РОЛЬ ТА ЗАСТОСУВАННЯ В МЕДИЦИНІ
1. ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ ТА МЕХАНІЗМ ЇХ ВИНИКНЕННЯ.
2. РІВНЯННЯ НЕРНСТА. СТАНДАРТНІ ЕЛЕКТРОДНІ ПОТЕНЦІАЛИ.
3. СТАНДАРТНИЙ ВОДНЕВИЙ ЕЛЕКТРОД. ЕЛЕКТРОДИ ПЕРШОГО І ДРУГОГО РОДУ.
4. ОКИСНО-ВІДНОВНІ ЕЛЕКТРОДИ. РІВНЯННЯ ПЕТЕРСА.
5. ЙОНСЕЛЕКТИВНІ ЕЛЕКТРОДИ. СКЛЯНИЙ ЕЛЕКТРОД.
1. Електрохі́мія — галузь науки, яка вивчає властивості систем, що містять іонні провідники, та перетворення речовин на межі поділу фаз за участю заряджених часток (іонів, електронів).
Якщо пластинку будь-якого металу, наприклад, цинку занурити у воду, то іони цинку, що утворюють кристалічну решітку металу, під дією полярних молекул води гідратуються, зв'язок їх з решіткою послаблюється, і деяка їх кількість, відриваючись від металу, перейде й воду, а на металі залишиться еквівалентна кількість електронів:
Zn = Zn2+ + 2e-
Між катіонами металу, що перейшли у воду, і негативно зарядженою пластинкою виникає електростатичне притягання, яке зумовлює зворотній процес — перехід іонів металу на пластинку; в системі встановлюється хімічна рівновага. Іони цинку переходять із пластинки в розчин і осідають з розчину на пластинці з однаковою швидкістю. На межі між металом і розчином утворюється подвійний електричний шар і виникає стрибок потенціалу. Чим міціше кристалічна решітка металу, тим важче іону металу перейти у розчин. Чим більша величина теплоти гідратації, тим легше іонам перейти у розчин. Отже, при зіткненні металу з водою його йони перебувають під дією двох конкуруючих сил. Якщо рідина — вода, то для всіх металів в якісному відношенні картина буде однозначною: метал заряджається негативно, шар рідини, що прилягає до нього, позитино. Інша картина спостерігається у випадку, якщо металеву пластинку занурити в розчин солі цього металу. Якщо метал неактивний, то буде переважати процес осадження іонів з розчину, І пластинка такого металу набуває позитивного заряду.
|
|
|
Отже при зануренні металевої пластинки у розчин власної солі на місці зіткнення металу з розчином виникає стрибок потенціалу, величина і знак якого залежать від хімічної природи металу та від активності його йонів у розчині.
Електродний потенціал — різниця електричних потенціалів між електродом та електролітом, в контакті з яким він знаходиться (найчастіше всього між металом і розчином електроліту).
Провідник (метал), занурений у розчин електроліту, називається електродом.
В залежності від природи електродної реакції розрізняють декілька типів електродів:
· електроди першого роду,
· другого роду,
· окислювально-відновні,
· іонселективні.
Електродом першого роду називають метал або неметал, занурений в розчин, який містить його іони. Електрод першого роду можна представити у вигляді схеми: Mz+ | M
· Рівняння електродної реакції: Mz+ + ze ⇔ M
Електрод другого роду складається з металу, покритого шаром його важкорозчинної солі і зануреного в розчин, який містить аніони цієї солі.
Електрод другого роду записують у вигляді схеми А- | МА, М.
Рівняння електродної реакції:
· МА+zе ⇔ М + Аz-
Величину електродного потенціалу можна розрахувати за рівнянням Нернста:
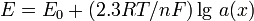
Для Т=298 К:

Нормальний водневий електрод являє собою платинову пластинку, покриту платиновою черню, занурену в розчин кислоти, активність іонів Н+ у якому дорівнює 1 моль/л. Через розчин пропускають ретельно очищений воднь під тиском 101325 Па (1 ат.). Поверхня платини покривається шаром газоподібного водню. На межі газоподібний водень — іони гідрогену проходить реакція.
Електрод, потенціалякого визачають, називають Електродом визначення. Інший електрод з відомим значенням електродного потенціалу називають електродом порівняння. ЕРС гальванічного елемента дорівнює максимальній різниці електродних потенціалів.
|
|
|
Роль електрода порівняння частіше за все відіграє водневий електрод, електродний потенціал якого умовно визначається приймається за нуль.
Величина електродного потенціалу залежить від активності речовин-учасників електродного процесу і вимірюється за допомогою рівняння Нернста:

де φ — електродний потенціал;
φ0 — стандартний електродний потенціал (потенціал, який виникає на границі метала з розчином його іонів при концентрації останніх 1 моль/л);
R — універсальна газова стала (R =8,31 Дж/(моль. К));
T — абсолютна температура;
n — число електронів, які беруть участь в електрохімічному процесі;
F — число Фарадея (F= 96 500 Кл);
Men + — концентрація іонів метала, моль/л.
Окисно-відновний потенціал -(оксредпотенціал, заст. редокспотенціал) — електрохімічний потенціал φ ox/red, який виникає на хімічно інертному електроді під час занурення його в розчин оборотної окисно-відновної системи, яка містить одночасно сполуку в окисненій і відновленій спряжених формах .. (окисно-выдновний електрод). О.в.п. залежить від природи системи та співвідношення окисненої та відновленої форм.
Рівняння Нернста
Е h= φ ox/red − 0= ЕО + (RT/ n F) ln a ox/ a red,
де a ox і a red − активності окисненої та відновленої форм сполуки відповідно; T — абсолютна температура, К; R — універсальна газова стала (8,3143 Дж∙град-1∙моль-1); F — число Фарадея (9,64872∙104 А∙с∙моль-екв-1); Е h — потенціал, віднесений до нормального водневого електрода у вольтах; ЕО — відповідає значенню Е h за активностей окисненої та відновленої форм, що дорівнюють одиниці, і називається стандартним потенціалом спряженої пари окисник-відновник.
Окисно-відновні системи, які мають біологічне значення, характеризує величина Е m, в якій враховане значення рН (Е m = Е0ʹ — 0,059 рН).
О.в.п. можна визначати потенціометричним (див. Потенціометрія) або індикаторним (колориметричним) методами. Визначення величини стандартних (формальних) О.в.п. дає можливість розрахувати величину стандартної (формальної) зміни вільної енергії для випадків, коли реагують дві окисно-відновні пари:
|
|
|
Δ G0ʹ =− nF Δ Е0ʹ,
де Δ G0ʹ — стандартна (формальна) зміна вільної енергії Гіббса у Дж; n — кількість перенесених електронів; F — число Фарадея; Δ Е0ʹ — різниця стандартних (формальних) О.в.п. акцептора і донора електронів (або донора й акцептора гідрогену відповідно).
Іонселективні електроди - інший тип електродів, в електродній реакції яких електрони участі не беруть, а їх потенціали визначаються процесами розподілу іонів між мембраною і розчином.
Такі електроди дають змогу селективно визначати який-небудь іон в присутності інших іонів, їх називають іонселективними електродами (ІСЕ). Першим ЇСЕ був — скляний електрод. Нині створені ІСЕ на основі рідких та твердих іонітів, моно- і полікристалів, елементоорганічних сполук, мембраноактивних комплексонів.
Іонселективні електроди дозволяють специфічно та якісно визначити дуже велику кількість речовин, в тому числі прості неорганічні іони, гази, складні органічні сполуки. Широкі можливості застосування, невелика витрата досліджуваної речовини, а також простота процесу вимірювання дозволяють використовувати ІСЕ в дослідженнях з фізіології, біології, при вивченні навколишнього середовища і т. ін.
Скляний електрод -найбільш розповсюджений ІСЕ. Стекла, які містять оксиди кремнію, натрію і кальцію, мають різко виражену специфічну спорідненість до іонів Н+. Внаслідок цього при контакті з кислими розчинами іони натрію в поверхневому шарі скла майже повністю заміщуються на іони Н+. Таким чином, в кислих, нейтральних і слаболужних розчинах скляні електроди із вказаних вище стекол використовуються для вимірювань рН.
Схема скляного електрода з водневою функцією має вигляд:
Н+| скл. мембрана | НСl || АgСl, Ag.
ЕЛЕКТРОХІМІЧНІ (ГАЛЬВАНІЧНІ) ЕЛЕМЕНТИ ТА ЕЛЕКТРОРУШІЙНІ СИЛИ.
ДИФУЗІЙНІ ТА МЕМБРАННІ ПОТЕНЦІАЛИ, ЇХ БІОЛОГІЧНЕ ЗНАЧЕННЯ.
БІОПОТЕНЦІАЛИ.
ПОТЕНЦІОМЕТРИЧНІ МЕТОДИ ДОСЛІДЖЕННЯ В МЕДИЦИНІ.
|
|
|
Гальванічний елемент - джерело живлення, в якому використовується різниця електродних потенціалів двох металів, занурених у електроліт.
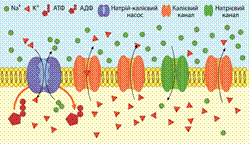
Мембра́нний потенціа́л споко́ю (МПС) — церізниця потенціалів між зовнішньою та внутрішньою сторонамимембрани в умовах, коликлітина не збуджена.Цитоплазмаклітини заряджена негативно по відношенню до позаклітинної рідини через нерівномірний розподіл аніонів та катіонів по дві сторони мембрани. Різниця потенціалів (напруга) для різних клітин має значення від −50 до −200 мВ (мінус означає, що всередині клітина більш негативно заряджена ніж зовні). Мембранний потенціал спокою виникає на мембранах всіх клітин і збудливих (нервів, м'язів, секреторних клітин) і незбудливих.
МПС необхідний для підтримання збудливості таких клітин, як м'язові та нервовоі. Також він впливає на транспорт всіх заряджених частинок у будь-якому типі клітин: він сприяє пасивному транспорту аніонів із клітини та катіонів у клітину.
Утворення та підтримання мембранного потенціалу забезпечують різні типи іонних насосів(зокрема натрій-калієвий насос або натрій-калієва АТФаза) та іонних каналів (калієві, натрієві, хлорні іонні канали).
Рівноважний потенціал для певного іона, наприклад для калію, можна обрахувати за рівнянням Нернста, що має наступний вигляд:
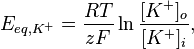 ,
,
де R — універсальна газова стала, Т — абслоютна температура (по шкалі Кельвіна), z — заряд іона, F — число Фарадея, [K+]o, [K+]i — концентрація калію зовні та всередині клітини відповідно. Оскільки описані процеси відбуваються за температури тіла — 310° К, а десятковимилогарифмами в обчисленні користуватись легше ніж натуральними, це рівняння перетворюють наступним чином:

Підставляючи концентрації К+ у рівняння Нернста отримуємо рівноважний потенціал для калію, що становить −90 мВ. Оскільки за нульовий потенціал приймається зовнішня сторона мембрани, то знак мінус означає, що за умов рівноважного калієвого потенціалу внутрішня сторна мембрани порівняно більш електронегативна. Аналогічні обрахунки можна провести і для рівноважного натієвого потенціалу, він становить +62 мВ.
У 1943 році Девід Голдаман запропонував вдосконалити рівняння Нернста так, щоб воно відображало вплив різних іонів на мембарнний потенціал, в цьому рівнянні враховується відносна проникність мембрани для кожного типу іонів:
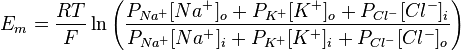
де R — універсальна газова стала, Т — абслоютна температура (по шкалі Кельвіна), z — заряд іона, F — число Фарадея, [іон]o, [іон]i — концентрації іонів зовні та всередині клітин, Р — відносна проникність мембрани для відповідного іона. Значення заряду в даному рівнянні не записується, але воно враховане — для хлору зовнішня і внутрішня концентрація поміняні місцями, так як його заряд −1.
Мембранні електричні потенціали існують фактично у всіх клітин організму. Деякі клітини, наприклад нервові і м'язові, здатні генерувати швидко-змінюються електрохімічні імпульси, які використовуються для передачі сигналів вздовж мембран цих клітин.У клітинах інших типів, наприклад залізистих, макрофагах і реснитчатих, локальні зміни мембранних потенціалів також активують багато клітинні функції.
Мембранний потенціал спокою може існувати тільки за умови нерівномірного розподілу іонів, що забезпечується функціонуванням натрій-калієвого насосу. Окрім того, цей білок робить також має електрогенні властовості — він переносить 3 катіони натрію в обмін на 2 іони калію, що рухаються всередину клітини. Таким чином, Na+-K+-АТФаза знижує МПС на 5-10 мВ. Пригнічення діяльності цього білка призводить до незначного (на 5-10 мВ) миттєвого підвищення мембранного потенціалу, після чого він ще деякий час існуватиме на досить стабільному рівні, поки будуть зберігатись градієнти концентрацій Na+ та K+. Згодом ці градієнти почнуть зменшуватись, внаслідок проникнсоті мембрани до іонів, і через кілька десятків хвилин електричний потенціал на мембрані зникне.
Дифузійний потенціал, Обумовлений розходженням іонних концентрацій по обидва боки мембрани. Концентрація іонів калію всередині нервового волокна - висока, але зовні -дуже низька. Припустимо, що в цьому випадку мембрана проникна для іонів калію, але непроникна для інших іонів. Через велику градієнта концентрації існує потужна тенденція до дифузії з клітки через мембрану великого числа іонів калію. В процесі дифузії вони виносять назовні позитивні електричні заряди, в результаті мембрана зовні заряджається позитивно, а всередині - негативно, оскільки залишилися всередині негативні аніони не дифундують з клітки разом з іонами калію.
ПОТЕНЦІОМЕТРИЧНІ МЕТОДИ ДОСЛІДЖЕННЯ В МЕДИЦИНІ.
Потенціометрія (рос. потенциометрия, англ. potentiometry, нім. Potentiometrie f) – фізико-хімічний метод кількісного аналізу, що ґрунтується на вимірюванні електрохімічного потенціалу електрода в розчині досліджуваної речовини. Застосовують для визначення концентрації електролітів. П. використовується також в автоматизованих системах аналітичного контролю.
Потенціометричне визначення рН — електрометричний метод визначення активності іонів гідрогену у вигляді водневого показника рН (див. Водневий показник), що базується на вимірюванні різниці потенціалів, які виникають на межі зовнішньої поверхні рН-селективної мембрани скляного електрода і випробовуваним розчином, з одного боку, та внутрішньої сторони мембрани і стандартним розчином кислоти — з іншого (див. Скляний рН-електрод) за умов нульового значення струму в колі.
На практиці П.в. рН здійснюють шляхом вимірювання різниці потенціалів кола з перенесенням іонів, складеного зі скляного рН‑електрода, оборотного до активності іонів гідрогену, та хлоридосрібного електрода порівняння, насиченого хлоридом калію:
(–) Ag, AgCl | KCl (нас.) Н+ || скляна мембрана || HCl (0,1 М) | AgCl, Ag (+)
електрод порівнянняскляний електрод
Різниця потенціалів скляного та хлоридосрібного електродів кола при 298 К: Е=φcкл–φAg,AgCl|Cl-=φо–0,059 рН–φAg,AgCl|Cl-. Оскільки потенціал хлоридосрібного електрода та стандартний потенціал скляного електрода (внутрішній електрод порівняння) величини постійні, можна записати: Е=const–0,059 pH. Вимірювання різниці потенціалів електродної системи здійснюють компенсаційним методом за допомогою іономіра, який попередньо градуюють в одиницях рН за стандартними буферними розчинами з точно відомим значенням величини рН. За умов збереження постійного значення дифузійного потенціалу після заміни стандартного буферного розчину досліджуваним розчином значення інструментальної величини рН випробовуваного розчину пов’язане з рН стандартного буферного розчину (рНст) таким рівнянням:
рН = рНст (E — Eст)F/2,303 RT
де Е — різниця потенціалів, яку спостерігають, у випробовуваному розчині, у вольтах; Ест — різниця потенціалів такої самої пари електродів у стандартному буферному розчині з відомим значенням рНст, у вольтах; T — абсолютна температура розчину, К; R — універсальна газова стала, дорівнює 8,314 Дж·град–1моль–1; F — число Фарадея, яке дорівнює 96485 Кл моль–1; n — кількість електронів, перенесених під час реакції, в розрахунку на 1 мол. м. еквівалента речовини. П.в. рН точніше за колориметричний, воно дає можливість здійснювати вимірювання показника активності іонів гідрогену з похибкою ±0,02–0,05 рН в інтервалі від 1 до 12 залежно від експлуатаційних характеристик скляного електрода та іономіра (рН-метра). П.в. рН є фармакопейним методом, його застосовують при контролі якості ЛП, для дослідження процесів у клітинах і тканинах живого організму. П.в. рН має важливе клінічне значення (рН сечі може мати значення при диференціальній діагностиці алкалозу та ацидозу різної етіології).
До прямої П. слід віднести також оксредметрію — вимірювання реальних (формальних) і стандартних окисно-відновних потенціалів та констант рівноваги окисно-відновних реакцій.
Пряма П. має низку важливих переваг. У процесі вимірювань склад досліджуваного розчину не змінюється. При цьому, як правило, не є необхідним відокремлення речовини, яка визначається. Метод відносно легко можна автоматизувати, що дозволяє використовувати його для безперервного контролю технологічних процесів. Історично цей метод виявився першим і саме за його допомогою, починаючи з 30-х років ХХ ст., досліджувалися всі відомі на той час БАР. Складні біологічні об’єкти: суспензії мітохондрій і хлоропластів — вивчали і вивчають нині потенціометричним методом.
При аналізі більш поширеними є методи потенціометричного титрування, за допомогою яких визначають більшість речовин у водних та неводних середовищах. При потенціометричному титруванні реєструють зміну потенціалу індикаторного електрода в процесі титрування досліджуваного розчину стандартним розчином реагента від об’єму останнього: кінцеву точку титрування (к.т.т.) установлюють за стрибком ΔЕ, спричиненим заміною однієї електрохімічної реакції іншою до та після к.т.т. з відповіднимφ0. Потенціометричне титрування проводять з використанням різноманітних реакцій: кислотно-основної та окисно-відновної взаємодій, осадження й комплексоутворення. В методах кислотно-основного титрування як індикаторний електрод можна використовувати будь-який електрод, оборотний до іонів Н+ (зазвичай скляний). Окисно-відновне титрування здійснюють з електродами з благородних металів (здебільшого з гладким платиновим). У методах осаджувального і комплексометричного титрування індикаторний електрод (іоноселективний або металічний) має бути оборотним щодо одного з іонів, які беруть участь у реакції.
Потенціометричне титрування можна виконувати автоматично до заздалегідь заданого значення різниці потенціалів, криві титрування (потенціограми) записують як в інтегральній, так і в диференціальній формі. За потенціограмами можна визначати удавані константи рівноваги (напр. змішані константи дисоціації кислот і основ) та значення потенціалу середньої точки (мідпойнт-потенціалу) φm (коли аох=аred).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3316; Нарушение авторских прав?; Мы поможем в написании вашей работы!