
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость реакции горения
|
|
|
|
Кинетика химических реакций горения.
Рассмотрим газофазную, изолированную, горючую систему стехиометрического состава, занимающую объём V.
При химическом превращении переход системы из начального состояния в конечное характеризуется определённой скоростью химических реакций.
Скорость химической реакции горения определяется числом молекул реагирующих веществ в рассматриваемом объёме. Значение скорости можно отнести к различным компонентам реагирующей смеси.
Скорость химической реакции по одному из компонентов определяется следующим образом
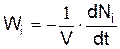 или
или
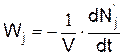
где Ni – число молекул i-го исходного вещества в момент времени t, Nj' – число молекул j-го конечного вещества в момент времени t.
Как известно, для измерения количества молекул можно использовать единицу системы СИ – 1 моль, содержащий в себе 6,02×1023 частиц вещества.
Связь между скоростями реакции по различным веществам устанавливается условиями сохранения элементного состава

где mik – число атомов k – го элемента в i – ой молекуле; Bk – общее число атомов в горючей системе.
Из условий сохранения можно получить, что

где Wi – скорость химической реакции по i – ому исходному веществу, Wj – скорость химической реакции по j – ому конечному веществу, W – скорость химической реакции, ni, nj – стехиометрические коэффициенты.
Если объём системы не меняется в ходе реакции, то скорость определяется производной объёмной концентрации во времени
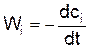 или
или

где сi – объёмная концентрация i – ого исходного вещества, сj' – объёмная концентрация j – ого конечного вещества.
В общем случае концентрация молекул в открытой системе может изменяться не только из-за протекания реакции горения, но и из-за теплового расширения газа или других газодинамических процессов.
|
|
|
Реакция между молекулами может произойти только при их столкновении, а число столкновений в газах пропорционально произведению концентрации реагирующих веществ.
Если реакция происходит в результате соударения двух молекул веществ А1 и А2, то скорость бимолекулярной реакции равна

где с1 – концентрация исходного вещества А1, с2 – концентрация исходного вещества А2, k – константа скорости реакции.
Константа скорости реакции зависит от температуры. Эта зависимость связана с тем, что не каждое столкновение реакционноспособных молекул А1 и А2 приводит к образованию новой молекулы, т.е. к химической реакции.
Чтобы прошла реакция, сталкивающиеся молекулы должны обладать достаточно большим запасом энергии, достаточным для преодоления определённого потенциального барьера. Эта энергия необходима для разрушения и изменения устойчивых химических связей и электронной структуры реагирующих веществ. Потенциальный барьер характеризуется энергией активации Еа.
Температурная зависимость константы скорости реакции, обусловленная энергией активации, описывается законом Аррениуса
 ,
,
где Rm – универсальная газовая постоянная, Т – температура, k0 – предэкспоненциальный множитель.
Предэкспоненциальный множитель характеризует полное число столкновений молекул, рассчитанное по средней скорости их теплового движения.
Экспериментально установлено, что в горении участвуют не только молекулы, но и другие активные частицы вещества.
Реакции соединения активных частиц, не требующие преодоления значительного потенциального барьера и проходящие с выделением большого количества энергии, не могут идти посредством бимолекулярной реакции, а происходят при участии третьей частицы. При столкновении двух активных частиц в образовавшемся соединении накапливается большой избыток энергии, который приводит к его быстрому распаду. Присутствие третьей, химически мало активной частицы приводит к отводу энергии и образованию устойчивого соединения.
|
|
|
Для тримолекулярной реакции типа
 ,
,
где М – третья частица, А1А2 – химический символ соединения;
скорость реакции
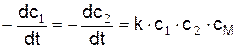 ,
,
где см – концентрация частиц М.
Для сложных молекул горючего их горение начинается с распада на части. Реакция распада молекулы зависит в основном от температуры. Для мономолекулярной реакции типа
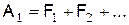
скорость реакции равна
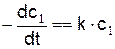
Моно-, би- и тримолекулярные реакции являются простыми, они представляют собой единичный акт химического превращения.
В общем случае для уравнения реакции
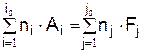
скорость записывается в виде

Приведённое соотношение называют законом действующих масс. Величина si = ni называется порядком реакции по веществу i. Суммарный порядок реакции равен
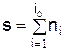 .
.
Суммарный порядок реакции, идущей в одну стадию, не может быть больше трёх. Экспериментальные исследования горения показали, что реакций с участием большего числа частиц не наблюдалось.
Большинство химических реакций горения являются сложными, протекающими в несколько стадий. Они описываются набором простых реакций, отражающих последовательные стадии химического превращения.
Экспериментальное определение скорости химических реакций состоит в измерении концентрации какого-либо реагирующего вещества и в дифференцировании зависимости концентраций по времени.
5.2. Химическое равновесие в реакциях горения
В действительности, даже в стехиометрической смеси превращение исходных веществ в конечные никогда не может пройти до полного преобразования исходных веществ. По достижении определённых условий становится значимым обратный процесс превращения конечных веществ в исходные, возникает динамическое равновесие прямого и обратного химического превращения.
Любая химическая реакция является обратимой. Наряду с прямой реакцией
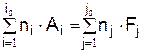 ,
,
протекающей со скоростью
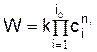
идёт обратная реакция

со скоростью
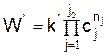
Если в каком-либо процессе скорости прямой и обратной реакции сравниваются, то дальнейшего изменения состава смеси не происходит, и система приходит к состоянию динамического равновесия.
|
|
|
Для равновесных концентраций исходных веществ и продуктов реакции справедливо следующее соотношение
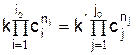
Из соотношения следует уравнение
 (6.3)
(6.3)
где К – константа равновесия.
Уравнение (6.3) представляет собой один из вариантов записи закона действующих масс.
Если реакция является сложной, то закон действующих масс справедлив и для каждой простой стадии этой реакции.
Константа равновесия зависит от молекулярных или атомных масс компонентов, находящихся в равновесии, а также от температуры.
Нагревая или охлаждая смесь можно сместить равновесие в ту или иную сторону.
При вычислении констант равновесия необходимо знать энергию реакции, массы частиц, их моменты инерции и частоты колебаний. Перечисленные свойства известны для большинства молекул, радикалов и атомов. Константы равновесия для многих реакций определены и приводятся в термодинамических таблицах, описывающих свойства индивидуальных веществ.
Определение констант скоростей прямой и обратной реакций в отличие от определения констант равновесия связано с большими сложностями, поэтому они известны с гораздо меньшей точностью, а зачастую и вообще неизвестны.
Химическое превращение конечных веществ в исходные имеет также название диссоциации продуктов горения.
По температуре и давлению горючей системы выделяют три области диссоциации продуктов горения:
- область отсутствия диссоциации,
- область слабой диссоциации,
- область сильной диссоциации.
Таблица. Области диссоциации продуктов горения
| Давление кПа | Температура, °С | ||
| Отсутствие диссоциации | Слабая диссоциация | Сильная диссоциация | |
| 10–500 | <1300 | 1300–2100 | >2100 |
| 500–2500 | <1500 | 1500–2300 | >2300 |
В таблице показаны термические условия для областей диссоциации.
5.3. Состав продуктов равновесного горения
Состав продуктов равновесного горения в отличие от стехиометрически полного горения определяется процессами диссоциации.
Предположим, что молекулы горючего вещества состоят из атомов углерода, водорода, кислорода и азота. При горении веществ указанного состава образуются продукты сгорания, содержащие только четыре химических элемента С, Н, О, N.
|
|
|
Уравнение реакции диссоциации углекислого газа записывается следующим образом
 ,
,
математическое выражение константы равновесия этой реакции имеет вид
 ,
,
где рсо – парциальное давление окиси углерода в продуктах равновесного горения.
Парциальное давление и концентрация связаны между собой известным соотношением
 ,
,
где R – газовая постоянная, Т – температура.
Уравнения реакций диссоциации продуктов горения и выражения констант равновесия этих реакций приведём в следующем виде (табл).
Таблица.
| № | Уравнение реакции диссоциации | Формула константы равновесия |

| 
| |

| 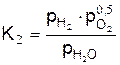
| |
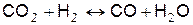
| 
| |

| 
| |

| 
| |

| 
| |

| 
| |

| 
|
Чтобы рассчитать состав продуктов равновесного горения нужно решить систему уравнений, включающую в себя:
§ уравнения констант равновесия реакций диссоциации,
§ уравнения баланса химических элементов,
§ уравнения общего количества продуктов горения.
Уравнения баланса химических элементов составляются путём приравнивания количества химического элемента, входящего в исходную смесь, к количеству элемента, содержащегося в продуктах сгорания.
Уравнения баланса химических элементов покажем на примере горючего газа следующего состава
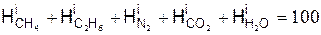 .
.
Уравнение баланса углерода имеет вид
 ,
,
где VCO – удельный объём окиси углерода в продуктах горения и т.д.
Уравнение баланса водорода имеет вид
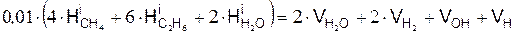
Уравнение баланса кислорода

Уравнение баланса азота
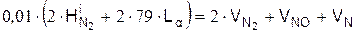
Численные значения констант равновесия приводятся в термодинамических таблицах. Переход от парциальных давлений к удельным количествам продуктов горения проводится по следующей формуле
 .
.
Удельное количество продуктов горения
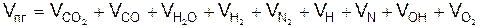
5.3.1. Расчёт равновесного неполного горения
Если пренебречь конечными веществами, парциальные давления которых в сумме не превышают 0,5%, то при коэффициенте расхода воздуха a < 1 в составе продуктов горения будут находиться N2, Н2О, СО2, СО, Н2.
Расчёт неполного горения сводится к следующему:
1). Проводится расчёт стехиометрически полного горения 1 м3 горючего газа при a=1. При этом вычисляются значения О1, L1, H2Oa=1, CO2a=1.
2). Удельное количество углекислого газа (м3/м3) при a<1 определяется из выражений:
 ,
,
 ,
,
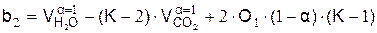 .
.
где b1 и b2 – вспомогательные величины, K – константа равновесия реакции водяного газа:
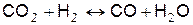 .
.
Константу равновесия можно определить из следующего выражения

где Тг – температура горения, К.
Температура горения может быть приближенно определена при помощи следующих выражений:
a) при tГ >950 °C
 ,
,
где iM – энтальпия продуктов горения при 2200 °C, QX – тепловая энергия горючих веществ в продуктах сгорания.
Энтальпия, кДж/м3, вычисляется по следующему выражению
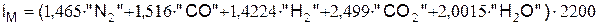 .
.
Тепловая энергия горючих веществ продуктов сгорания

б) при tГ < 950 °C

3). Удельное количество окиси углерода, (м3/м3)

4).Удельное количество водяного пара, (м3/м3)

5). Удельное количество водорода (м3/м3)

6). Удельное количество азота, (м3/м3)
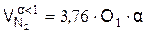
7). Удельное количество продуктов горения, (м3/м3)
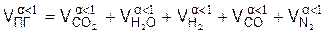
8) Процентный состав продуктов неполного горения
 , %, и т.д.
, %, и т.д.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3287; Нарушение авторских прав?; Мы поможем в написании вашей работы!