
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие цепной реакции
|
|
|
|
Микрокинетика реакций горения.
Кинетика реакций, основанная на столкновениях молекул и их тепловой активации, не объясняет целого ряда явлений горения. Существуют химические реакции, протекающие при низких температурах, но отличаются значительными скоростями. К числу таких реакций относятся, например, реакция низкотемпературного окисления фосфора, сопровождающаяся возникновением сравнительно холодного пламени. Кроме того, существует класс фотохимических реакций взрывного типа.
Для большинства реакций горения скорость, рассчитанная по числу молекул горючего и окислителя, не совпадает с экспериментальными значениями.
Кинетика реакций, основанная на столкновениях молекул, называется макрокинетикой горения, а кинетика, учитывающая участие в химических превращениях атомов, радикалов и других активных частиц, называется микрокинетикой горения.
В соответствии с микрокинетикой горения, исходные вещества превращается в ходе реакции в конечные не сразу, а посредством образования активных частиц, которые сравнительно легко вступают в дальнейшие соединения.
В результате этих соединений получаются конечные продукты, и одновременно, образуется некоторое количество активных веществ. Активные частицы могут вновь вступать в соединения, заново повторяя цикл превращений.
Повторение цикла будет происходить до тех пор, пока не прекратится воссоздание активных веществ.
Сложная реакция, в которой происходит последовательное повторение определённых превращений, описываемых простыми реакциями с участием активных частиц (звеньями), называется реакцией цепочечного типа или цепной реакцией. После начального возбуждения такая реакция повторяется несколько раз, не нуждаясь в подводе энергии извне.
|
|
|
В цепных реакциях при взаимодействии активных частиц с исходными или промежуточными веществами образуются как продукты реакции, так и новые активные вещества, т.е. по ходу реакции происходит регенерация активных частиц.
6.2.Цепная неразветвлённая реакция
Примером цепной неразветвлённой реакции может служить реакция взаимодействия водорода с хлором.
В соответствии с макрокинетикой, реакция водорода с хлором должна идти через столкновение молекулы водорода с молекулой хлора по уравнению
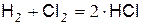 . (а)
. (а)
В соответствии с микрокинетикой, образование конечного продукта – хлористого водорода – происходит в результате последовательного чередования простых реакций с участием активных центров: атомарного хлора и атомарного водорода.
Первичными активными центрами являются атомы хлора, образующиеся при диссоциации молекулярного хлора при столкновениях типа
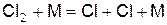 , (б)
, (б)
где М – частица вещества, обладающая энергией.
Данная реакция называется реакцией зарождения цепи. Молекула или атом М, участвующие в реакции зарождения, необходимы для разрыва химической связи в молекуле хлора.
Образованием атомарного водорода по аналогичной реакции
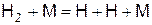 (в)
(в)
можно пренебречь, так как молекула водорода более прочна, чем молекула хлора, энергия связи для водорода составляет 24,6 кДж/моль, а для хлора – 13,6 кДж/моль.
Два атома хлора при тройном столкновении могут рекомбинировать, т.е. соединиться в молекулу
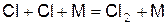 (г)
(г)
Реакция такого типа, сопровождающаяся исчезновением свободной валентности, называется реакцией обрыва цепи.
В присутствии молекулярного водорода атомы хлора могут реагировать иным путём, а именно
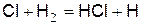 . (д)
. (д)
Концентрация атомов хлора мала и количество столкновений атомов хлора с молекулами водорода намного меньше, чем количество столкновений молекул хлора с молекулами водорода. Несмотря на меньшее число столкновений, реакция атома хлора с молекулой водорода идёт гораздо быстрее, чем бимолекулярная реакция водорода с хлором. Причина в том, что энергия активации реакции с участием атомарного хлора составляет 1,2 кДж/моль, а при молекулярном хлоре – 9,6 кДж/моль.
|
|
|
Атомы хлора реагируют быстро, но образуются очень медленно, поэтому их участие не объясняет большой скорости всего процесса в целом.
Объяснение заключается в том, что при образовании хлористого водорода возникает новый активный центр – атом водорода, который далее реагирует по реакции
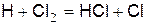 (е)
(е)
Данная реакция идёт с ещё большей скоростью, чем реакция атома хлора с водородом, так как она обладает меньшей энергией активации.
Реакции типа (д) и (е) называются реакциями продолжения цепи.
Любой из имеющихся в горючей системе атомов хлора, вступая в реакцию (д), за которой неизбежно следует реакция (е), восстанавливается после образования двух молекул HCl. Это подтверждает запись уравнения, обобщающего реакции (д) и (е)
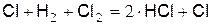 (ё)
(ё)
Регенерируемый атом хлора опять вступает в реакцию (д) и т.д. Небольшое количество атомов хлора ведет реакцию горения водорода, причём сами эти атомы практически не расходуются, количество их примерно постоянно.
Скорость горения водорода в хлоре определяется микрокинетикой процесса и зависит от самой медленной стадии. Лимитирующей стадией является реакция (е), поэтому скорость горения водорода
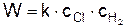
При температуре Т=600 К и давлении 101,3 кПа скорость реакции (е) в 106 раз больше, чем скорость бимолекулярной реакции (а).
6.3.Цепные разветвлённые реакции
Примерами цепных разветвлённых реакций могут служить реакция взаимодействия водорода, окиси углерода и метана с кислородом.
В соответствии с макрокинетикой, реакция горения водорода в кислороде должна идти через столкновение двух молекул водорода с молекулой кислорода по уравнению
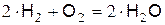 , (а)
, (а)
но этого не происходит. Конечный продукта – Н2О образуется в результате определённой последовательности простых реакций с участием активных центров: атомарного водорода, атомарного кислорода и радикала ОН.
Первичными активными центрами являются атомы водорода, образующиеся при диссоциации молекулярного водорода при столкновениях с частицами, обладающими энергией
|
|
|
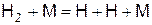 (б)
(б)
где М – частица вещества, обладающая энергией.
Реакциями продолжения цепей являются
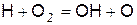 , (в)
, (в)
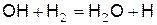 , (г)
, (г)
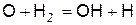 , (д)
, (д)
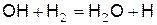 , (е)
, (е)
Уравнение, суммирующее реакции (в), (г), (д) и (е), имеет вид
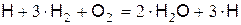 (ё)
(ё)
В ходе реакций расходуется один активный атом водорода, но появляется три новых атома.
Цепную разветвляющуюся реакцию горения водорода можно представить схематически
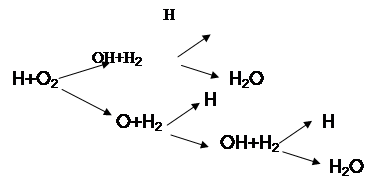 |
Дальнейшее развитие цепей приводит к лавинообразному нарастанию атомов водорода. Одновременно происходит обрыв цепей в результате гибели активных частиц
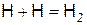 .
.
Если реакционное пространство горючей системы ограничено твёрдыми стенками, то гибель активных центров может происходить на поверхности стенки сосуда.
Самоускорение разветвлённой цепной реакции связано с тем, что скорость гибели активных частиц меньше скорости их образования.
Скорость горения водорода в кислороде определяется реакцией (в),
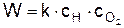
так как её энергия активации наибольшая – 75 кДж/моль (для сравнения при реакции (г) – 42 кДж/моль, а при реакции (д) –25 кДж/моль).
При температуре до 700 °C сухая окись углерода СО с кислородом практически не реагирует. При температуре выше 700 °C на поверхности ограничивающей реакционное пространство начинается медленная гетерогенная реакция
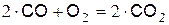 , (а)
, (а)
В присутствии молекул воды сложная реакция горения СО описывается последовательностью простых реакций, имеющих цепной характер.
Зарождение цепей связано с появлением в смеси водорода по реакции
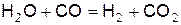 , (б)
, (б)
Активные частицы возникают по реакции
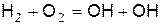 (в)
(в)
В ходе горения возникают атомы водорода по реакции
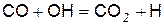 , (г)
, (г)
которые обеспечивают воспроизводство радикалов по реакциям
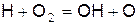 (д)
(д)
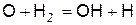 (е)
(е)
Обрыв цепей возможен на холодной поверхности и в объёме смеси
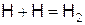 ,
,
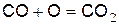
Самой медленной реакцией в цепи химических превращений является реакция (б). Скорость горения окиси углерода пропорциональна начальной концентрации водяного пара в смеси, поэтому
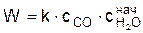 ,
,
где Сн2о – начальная концентрация водяного пара в смеси.
|
|
|
Рассмотрим одну из возможных схем цепного горения метана. Метан при определённых температурах в присутствии кислорода легко отделяет один из атомов водорода:
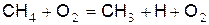 (а)
(а)
Атомарный водород реагирует с молекулой кислорода
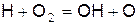 (б)
(б)
В дальнейшем идёт реакция диссоциации радикала СН3
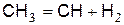 (в)
(в)
или образуется неустойчивый метиловый спирт
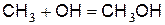 (г)
(г)
При взаимодействии радикала СН с радикалом ОН образуются окись углерода и водород
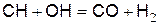 (д)
(д)
Метиловый спирт окисляется с образованием формальдегида
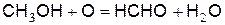 (е)
(е)
Формальдегид диссоциирует по реакции
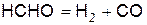 (ё)
(ё)
Молекулы Н2 и СО выгорают по цепным реакциям.
Скорость реакции горения метана
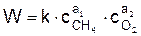 .
.
По экспериментальным данным а1 = 0.5–2; а2 = 0.25–1,5.
В пламени горящего метана одновременно находятся частицы СН4, О2, СН2, Н, ОН, О, СН, СН3ОН, СО, Н2, НСНО.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 772; Нарушение авторских прав?; Мы поможем в написании вашей работы!