
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамическая система. Термические и калорические параметры состояния системы
Предмет и метод технической термодинамики
Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принцип действия и конструкцию тепловых машин, аппаратов и устройств.
Теоретическими разделами теплотехники являются техническая термодинамика и теория тепломассообмена.
Техническая термодинамика – наука, изучающая взаимное превращение теплоты в работу и обратно. Понятие «термодинамика» было впервые введено в 1824 г. французским ученым Сади Карно.
В основу термодинамики положены два основных закона, установленных опытным путем. Первый закон термодинамики характеризует количественную сторону процессов превращения энергии, а второй закон устанавливает качественную сторону (направление) процессов, происходящих в термодинамической системе.
Все процессы в термодинамике изучаются термодинамическим методом, сущность которого заключается в следующем:
1) все системы в термодинамике являются макроструктурами, т.е. состоят из большого числа молекул;
2) изучение основывается на первом и втором законах термодинамики;
3) все процессы в термодинамике являются равновесными, т.е. параметры во всех точках системы остаются одинаковыми.
Ученые, внесшие существенный вклад в развитие теплотехники:
М.В. Ломоносов (1711–1765) – один из основоположников молекулярно-кинетической теории, сформулировал закон сохранения материи и движения, впервые предсказал существование абсолютного нуля температуры;
И.И. Ползунов (1728–1766) – русский изобретатель, создатель первой в России паровой машины и первого в мире двухцилиндрового парового двигателя;
Д.И. Менделеев (1834–1907) – русский ученый, вывел уравнение состояния идеального газа, разработал теорию теплоёмкостей, открыл существование для каждого вещества критической температуры, впервые высказал идею подземной газификации угля;
М.П. Вукалович (1898–1969) – теоретически и экспериментально исследовал теплофизические свойства воды и водяного пара, разработал уравнение состояния реальных газов.
Термодинамическая система – совокупность тел, которые могут энергетически взаимодействовать между собой и с окружающей средой, а также обмениваться с ней массой вещества.
Термодинамические системы могут быть:
1) открытыми – в таких системах происходит обмен энергией и веществом с окружающей средой;
2) закрытыми – в таких системах происходит обмен с окружающей средой только энергией;
3) изолированными – в таких системах не происходит обмена с окружающей средой ни энергией, ни веществом;
4) адиабатными – в таких системах отсутствует теплообмен с окружающей средой.
Как известно, вещество может находиться в четырех состояниях:
1) твёрдом;
2) жидком;
3) газообразном;
4) в состоянии плазмы.
Физические величины, характеризующие состояние вещества в системе, называются параметрамисостояния. Параметры состояния подразделяются на термические и калорические.
К термическим параметрам состояния относятся:
Т – термодинамическая (абсолютная) температура, К;
P – полное (абсолютное) давление, Па;
v – удельный объём, м3/кг.
Температура характеризует степень нагретости тела и является мерой средней кинетической энергии теплового движения его молекул. В соответствии с молекулярно-кинетической теорией температура связана со скоростью движения молекул следующей зависимостью:
 , (1.1)
, (1.1)
где m – масса молекулы;
w – средняя скорость движения молекул;
k – постоянная Больцмана, k = 1,38·10-23 Дж/К;
Т – термодинамическая (абсолютная) температура, К.
Первое известное устройство для измерения температуры (термоскоп) было создано Г. Галилеем в 1597 г. В этом приборе использовано явление изменения объёма газа при его нагревании и охлаждении.
Немецкий физик Г. Фаренгейт изготовил первый спиртовой (1709 г.) и ртутный (1714 г.) термометры, предложил температурную шкалу (1724 г.), названную его именем. За ноль на этой шкале принята температура замерзания смеси воды, льда и нашатыря, а за 96 °F – нормальная температура человеческого тела. Шкала Фаренгейта применяется и сегодня в США и Великобритании.
Привычная нам температурная шкала была предложена А. Цельсием в 1742 г. Опорными точками для нее являются температура таяния льда (0° C) и температура кипения воды (100° C) при нормальном атмосферном давлении.
Шкалы Цельсия и Фаренгейта не являются абсолютными и поэтому неудобны при проведении экспериментов в условиях, когда температуру приходится выражать отрицательным числом.
Понятие абсолютной температуры было введено У. Томсоном (лорд Кельвин) в 1848 г., в связи с чем шкала абсолютной температуры называется шкалой Кельвина, или термодинамической температурной шкалой. За абсолютный ноль по шкале Кельвина принимается температура, при которой хаотическое движение частиц прекращается, и они образуют упорядоченную структуру. Один кельвин (К) равен 1/273,16 части термодинамической температуры тройной точки воды. Тройная точка воды – температура равновесия газообразной, жидкой и твердой фаз воды. В соответствии с МТШ-90 (Международная температурная шкала, принятая в 1990 г.) температуре тройной точки воды присвоено значение 273,16 К.
По шкале Цельсия абсолютному нулю соответствует температура −273,15 °С. Пересчет температуры из градусов Цельсия в кельвины и обратно осуществляется по следующим формулам:
Т (К) = t (°С) + 273,15; t (°С) = Т (К) – 273,15. (1.2)
· Самая низкая температура 5,9∙10−12 К, т. е. менее чем 1/170 млрд. доля градуса, была получена Э. Корнеллом и К. Виманом (США) в 1995 году [2].
· Самая высокая температура, созданная человеком (~ 4 трлн. К), была достигнута в 2010 г. в Брукхейвенской национальной лаборатории (США) [2].
Давление – физическая величина, характеризующая состояние газа (жидкости) и определяемая как отношение силы, действующей в направлении по нормали к поверхности, к площади этой поверхности.
Различают следующие виды давлений:
1) атмосферное (барометрическое), обозначается Р атм, В;
2) манометрическое – избыточное над атмосферным, Р ман, Р изб;
3) вакуумметрическое – ниже атмосферного, Р вак;
4) полное (абсолютное) давление, Р.
Полное давление Р – давление, отсчитываемое от абсолютного нуля давления (абсолютного вакуума), является параметром состояния термодинамической системы и определяется по одному из выражений:
при давлении в сосуде выше атмосферного
 , (1.3)
, (1.3)
при давлении в сосуде ниже атмосферного
 . (1.4)
. (1.4)
Единицей давления в системе СИ является паскаль (Па). Давление в 1 Па оказывает сила в 1 Н, равномерно распределённая на площади 1 м2. Применяются также более крупные кратные единицы: кПа, МПа:
1 кПа = 1000 Па = 103 Па, 1 МПа = 1000000 Па = 106 Па.
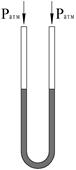
Кроме паскалей находят применение и внесистемные единицы давления: атмосфера техническая (ат) и атмосфера физическая (атм), бар. Давление может быть выражено высотой столба жидкости (ртути, воды, спирта и др.), уравновешивающего давление газа в сосуде. Из приборов, применяемых для измерения давления, простейшими и вместе с тем самыми точными являются U -образные жидкостные манометры. U -образный манометр (рис. 1, а) представляет собой две сообщающиеся трубки, заполненные до половины жидкостью.
| 
| 
|
| а) | б) | в) |
| Рис. 1. U-образный жидкостный манометр (а); измерение избыточного (б) и вакуумметрического (в) давлений. |
Отсчет производят по шкале, имеющей нулевую отметку в равновесном состоянии. Разность уровней h определяет измеряемое избыточное P изб или вакуумметрическое P вак давление.
Перевод давления, выраженного высотой столба жидкости, в паскали осуществляется по формуле
 , (1.5)
, (1.5)
где ρ – плотность используемой в манометре жидкости, кг/м3;
g – ускорение свободного падения, м/с2;
h – разность уровней жидкости в манометре, м.
Соотношение между различными наиболее распространенными единицами измерения давления приведены в табл. 2.
Удельный объём – объём, занимаемый единицей массы вещества. В технической термодинамике удельный объём обозначается v и измеряется в м3/кг:
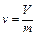 , (1.6)
, (1.6)
где V – объём вещества, м3;
m – масса вещества, кг.
Таблица 2. Соотношение между различными единицами измерения давления
| Единицы измерения | Атмосфера техническая, ат (кгс/см2) | Атмосфера физическая, атм | Паскаль, Па | Мм рт. ст. | Мм вод. ст. | Бар |
| 1 атмосфера техническая, ат (кгс/см2) | 0,96784 | 9,80665∙104 | 735,559 | 10000,28 | 0,980665 | |
| 1 атмосфера физическая, атм | 1,03323 | 1,01325∙105 | 10332,57 | 1,01325 | ||
| 1 паскаль, Па | 1,0197∙10-5 | 0,986923∙10-5 | 7,5006∙10-3 | 1,01974∙10-1 | 10-5 | |
| 1 мм рт. ст. | 1,35951∙10-3 | 1,31579∙10-3 | 1,3332∙102 | 13,59548 | 1,33322∙103 | |
| 1 мм вод. ст. | 0,99997∙10-4 | 0,967814∙10-4 | 9,80638 | 0,735539∙10-1 | 0,980638∙10-4 | |
| 1 бар | 1,01972 | 0,986923 | 105 | 750,062 | 10197,45 |
Величина, обратная удельному объёму, т.е. масса единицы объёма вещества, называется плотностью:
 , кг/м3;
, кг/м3;  , м3/кг;
, м3/кг;  . (1.7)
. (1.7)
Удельный объём и плотность зависят от давления и температуры, поэтому при сравнении этих величин для различных газов их приводят к нормальным физическим условиям (НФУ). Параметры нормальных физических условий следующие:
Р н = 101325 Па; Т н = 273,15 К.
Калорические параметры являются функциями состояния системы и могут быть подсчитаны на основании термических параметров состояния. К калорическим параметрам состояния относятся:
1) U – внутренняя энергия;
2) H – энтальпия;
3) S – энтропия.
Эти функции не зависят от направления и пути процесса, а зависят только от параметров начального и конечного состояния системы.
Внутренняя энергия – это сумма всех видов энергии, которыми обладает тело или система, включающая:
1) кинетическую энергию поступательного движения молекул;
2) кинетическую энергию вращательного движения молекул;
3) кинетическую энергию колебательного движения атомов;
4) потенциальную энергию взаимодействия между молекулами.
Первые три вида энергии зависят от температуры, а, поскольку в идеальном газе силы взаимодействия между молекулами отсутствуют, его потенциальная энергия равна нулю. Следовательно, внутренняя энергия идеального газа зависит только от его температуры.
Различают внутреннюю энергию тела или системы U (Дж) и удельную внутреннюю энергию u (Дж/кг), определяемую по формуле
u = Cv · T, (1.8)
где Cv – удельная изохорная теплоёмкость газа.
Тогда полная внутренняя энергия тела или системы
U = m · u = m · Cv · T. (1.9)
При выполнении теплотехнических расчетов чаще требуется найти не величину удельной внутренней энергии, а её изменение в каком-либо процессе, определяемое по формуле
Δ u 1–2 = Cv ·(T 2 – T 1). (1.10)
Энтальпия – (от греч. enthalpo – нагреваю) функция состояния термодинамической системы, связанная с ее внутренней энергией U соотношением
H = U + Р · V. (1.11)
При постоянном давлении изменение энтальпии равно количеству теплоты, подведённой к системе, поэтому энтальпию часто называют тепловой функцией, или теплосодержанием. Энтальпия – это количество теплоты, которое необходимо для нагревания тела от нуля до заданной температуры в процессе при постоянном давлении.
Различают энтальпию тела или системы H (Дж) и удельную энтальпию h (Дж/кг):
h = u + P · v = Cp · T. (1.12)
где Cp – удельная изобарная теплоёмкость газа.
При выполнении теплотехнических расчетов чаще требуется найти не величину удельной энтальпии, а её изменение в каком-либо процессе, определяемое по формуле
Δ h 1–2 = Cp ·(T 2 – T 1). (1.13)
Энтропия – функция состояния термодинамической системы, изменение которой ds в равновесном процессе равно отношению количества подведённой или отведённой теплоты dq к термодинамической температуре Т системы:
 . (1.14)
. (1.14)
Различают энтропию тела или системы S (Дж/К) и удельную энтропию s (Дж/(кг·К)). При рассмотрении различных термодинамических процессов наибольший интерес представляет не значение энтропии, а ее изменение в процессе, определяемое по формуле
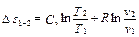 . (1.15)
. (1.15)
|
|
Дата добавления: 2014-01-07; Просмотров: 3845; Нарушение авторских прав?; Мы поможем в написании вашей работы!