
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основные законы идеальных газов
|
|
|
|
При изучении газов в термодинамике принято иметь дело с так называемым идеальным газом, под которым понимают такой газ, силы взаимодействия между молекулами в котором отсутствуют, а сами молекулы обладают массой, но не имеют объёма, т.е. являются материальными точками. Реальные газы в условиях, близких к нормальным, а также при низких давлениях и высоких температурах по своим свойствам близки к идеальному газу.
Полное давление газа в соответствии с молекулярно-кинетической теорией определяется из выражения
 , (1.16)
, (1.16)
где n – число молекул в объёме v.
С учётом равенства (1.1) выражение (1.16) примет вид
 или
или  . (1.17)
. (1.17)
Подставив в полученное выражение параметры начального и конечного состояния системы, получим
 ,
, 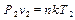 . (1.18)
. (1.18)
Разделив первое выражение на второе и выполнив необходимые преобразования, получим следующее соотношение:
 . (1.19)
. (1.19)
Выражение (1.19) показывает, что отношение произведения абсолютного давления газа на удельный объём к его абсолютной температуре для идеального газа есть величина постоянная, т.е.
 . (1.20)
. (1.20)
Последнее уравнение называют объединённым газовым законом. Частные случаи уравнения (1.20), когда один из параметров состояния газа остается неизменным, известны как законы идеальных газов.
Так, если процесс протекает при постоянной температуре, т.е. Т = const, то выражение (1.20) примет вид
 . (1.21)
. (1.21)
Уравнение (1.21) носит название закона Бойля–Мариотта, так как в 1662 г. Р. Бойлем и в 1676 г. Э. Мариоттом было установлено, что при постоянной температуре произведение давления газа на его объём есть величина постоянная, а процесс, описываемый выражением (1.21), называют изотермическим процессом.
Если процесс протекает при постоянном давлении, т.е. Р = const, то выражение (1.20) примет вид
|
|
|
 . (1.22)
. (1.22)
Уравнение (1.22) называют законом Гей-Люссака, так как автором (Жозеф Луи Гей-Люссак) в 1802 г. впервые было доказано, что в процессе нагрева или охлаждения газа при постоянном давлении отношение объёма газа к его температуре остается постоянным. Такой процесс называют изобарным.
Если процесс протекает при постоянном объёме, т.е. v = const (изохорный процесс), то выражение (1.20) примет вид
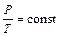 . (1.23)
. (1.23)
Полученное равенство известно как закон Шарля (Жак Александр Сезар Шарль): «в процессе, протекающем при постоянном объёме, давление газа прямо пропорционально его температуре».
Из уравнений (1.18) можно сделать вывод, что при одинаковых давлениях и температурах в равных объёмах различных газов содержится одинаковое количество молекул – закон Авогадро, открыт им в 1811 г. Следовательно, отношение плотностей двух газов будет прямо пропорционально отношению их молярных масс и обратно пропорционально отношению удельных объёмов, т.е.
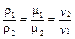 , (1.24)
, (1.24)
откуда получим
µ1 v 1 = µ2 v 2. (1.25)
Произведение молярной массы газа µ на его удельный объём v называется молярным объёмом:
 . (1.26)
. (1.26)
Молярный объём – объём одного моля (л/моль) или киломоля (м3/кмоль) вещества, характеризует плотность упаковки молекул. Молярные объёмы различных газов при одинаковых давлениях и температурах равны и при нормальных физических условиях для идеальных газов
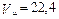 , м3/кмоль. (1.27)
, м3/кмоль. (1.27)
Например, для кислорода
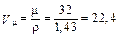 , м3/кмоль. (1.28)
, м3/кмоль. (1.28)
Моль – единица количества вещества в СИ. В 1 моле содержится столько молекул (атомов, ионов или других структурных элементов вещества), сколько атомов содержится в 0,012 кг 12С (углерода атомной массой 12), т.е. 6,022·1023. Это число известно как число Авогадро и обозначается NA = 6,022·1023 моль-1.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 441; Нарушение авторских прав?; Мы поможем в написании вашей работы!