
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Термодинамический процесс и его энергетические показатели
|
|
|
|
Термодинамическим процессом называется любое изменение состояния термодинамической системы, сопровождающееся изменением хотя бы одного из параметров состояния. Энергетическими показателями термодинамического процесса являются теплота q и работа l.
В технической термодинамике принято теплоту, подводимую к системе, считать положительной (рис. 2), а теплоту, отводимую от системы, – отрицательной.

|
| Рис. 2. К определению знаков теплоты и работы. |
Соответственно и работу, совершаемую системой, считают положительной, а работу, совершаемую над системой, – отрицательной.
2. Теплоёмкость
2.1. Удельная, объёмная и молярная теплоёмкость
Теплоёмкостью называют количество теплоты, которое необходимо подвести к телу (или отвести от него) для изменения его температуры на 1 К. Теплоёмкость тела является экстенсивным параметром, т.е. зависит от количества вещества в данном теле, поэтому при выполнении теплотехнических расчетов используют теплоёмкость, отнесенную к какой-либо количественной единице (кг, м3, кмоль) вещества. В зависимости от выбранной количественной единицы различают удельную, объёмную и молярную теплоёмкости.
Теплоёмкость, отнесённую к 1 кг вещества, называют удельной (Дж/(кг·К)) и обозначают С.
Теплоёмкость, отнесённую к 1 м3 вещества при нормальных физических условиях, называют объёмной (Дж/(м3·К)) и обозначают С'.
Теплоёмкость, отнесённую к 1 кмолю вещества, называют молярной (Дж/(кмоль·К)) и обозначают µ С.
Между приведенными выше теплоёмкостями существует следующая зависимость:
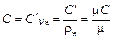 , (2.1)
, (2.1)
где v н и ρн – удельный объём и плотность вещества при нормальных физических условиях.
Количество теплоты, подводимой (или отводимой) к телу (или системе) при изменении его температуры от t 1 до t 2, может быть найдено по одному из следующих выражений:
|
|
|
 , (2.2)
, (2.2)
где V н – объём вещества при нормальных физических условиях, м3;
M – количество молей (киломолей) вещества, моль (кмоль).
2.2. Истинная и средняя теплоёмкость
Теплоёмкость идеального газа зависит от температуры, поэтому различают истинную и среднюю теплоёмкости. В общем случае зависимость теплоёмкости от температуры имеет вид
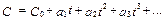 , (2.3)
, (2.3)
где C 0 – теплоёмкость при температуре 0° С;
а 1; а 2; а 3 – коэффициенты, определяемые опытным путем.
Графически зависимость теплоёмкости от температуры представляется степенной функцией, приведенной на рис. 3.

|
| Рис. 3. К определению средней теплоёмкости Cm при нелинейной зависимости теплоёмкости от температуры. |
Отношение элементарного количества теплоты dq, подведенного к телу или системе, к вызванному им изменению температуры тела dt, когда последнее стремится к нулю
 , (2.4)
, (2.4)
называется истинной теплоёмкостью.
Тогда из выражения (2.4) элементарное количество теплоты
 . (2.5)
. (2.5)
При бесконечно малом изменении температуры dt изменением теплоёмкости С можно пренебречь и в данном температурном интервале считать ее постоянной. Тогда величина dq будет равна площади прямоугольника с основанием dt и высотой С, а общее количество теплоты q 1–2, подведенной к телу для изменения его температуры от t 1 до t 2, определится из выражения
 , (2.6)
, (2.6)
как площадь криволинейной трапеции ABCD.
Заменив на рис. 3 криволинейную трапецию ABCD равновеликим ей по площади прямоугольником 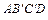 , получим
, получим
 , (2.7)
, (2.7)
где высота прямоугольника  является средней теплоёмкостью в интервале температур от t 1 до t 2 и обозначается
является средней теплоёмкостью в интервале температур от t 1 до t 2 и обозначается 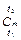 , а основание прямоугольника AD равно разности температур (t 2 – t 1).
, а основание прямоугольника AD равно разности температур (t 2 – t 1).
Средней теплоёмкостью 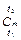 в интервале температур от t 1 до t 2 называется отношение подведенной в процессе теплоты q 1–2 к разности температур (t 2 – t 1):
в интервале температур от t 1 до t 2 называется отношение подведенной в процессе теплоты q 1–2 к разности температур (t 2 – t 1):
|
|
|
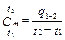 . (2.8)
. (2.8)
Тогда количество подведенной теплоты определится из выражения
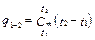 . (2.9)
. (2.9)
Количество подведенной теплоты q 1–2 может быть определено и другим способом (см. рис. 3):
 , (2.10)
, (2.10)
где 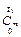 и
и  – средние теплоёмкости в интервалах температур от 0° С до t 1 и до t 2, значения которых берутся из таблиц.
– средние теплоёмкости в интервалах температур от 0° С до t 1 и до t 2, значения которых берутся из таблиц.
Приравняв правые части выражений (2.9) и (2.10), получим
 . (2.11)
. (2.11)
Выражение (2.11) применяется для определения средней теплоёмкости в заданном интервале температур от t 1 до t 2 при нелинейной зависимости теплоёмкости от температуры.
В ряде случаев для упрощения расчетов слагаемыми 2-го порядка и выше в выражении (2.3) пренебрегают, тогда оно принимает вид
 , (2.12)
, (2.12)
а зависимость теплоёмкости от температуры будет линейной (рис. 4).

|
| Рис. 4. К определению средней теплоёмкости Cm при линейной зависимости теплоёмкости от температуры. |
Средняя теплоёмкость в данном случае определится из выражения
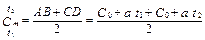 , (2.13)
, (2.13)
откуда окончательно получим
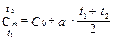 , (2.14)
, (2.14)
где а – тангенс угла наклона прямой, характеризующей зависимость теплоёмкости от температуры, который зависит от вида газа.
Выражение (2.14) используется для определения средней теплоёмкости в заданном интервале температур от t 1 до t 2 при линейной зависимости теплоёмкости от температуры.
В некоторых случаях при расчетах в небольших температурных интервалах зависимостью теплоёмкости от температуры пренебрегают и считают теплоёмкость величиной постоянной.
2.3. Изохорная и изобарная теплоёмкость
Теплоёмкость идеального газа зависит от характера процесса, в котором подводится или отводится теплота. Поэтому в термодинамике большое значение имеют теплоёмкость газа в процессе, протекающем при постоянном объёме Cv, и теплоёмкость в процессе, протекающем при постоянном давлении Cр. С учётом этого различают следующие виды теплоёмкости:
Cv – удельная изохорная теплоёмкость;
Cр – удельная изобарная теплоёмкость;
C'v – объёмная изохорная теплоёмкость;
C'р – объёмная изобарная теплоёмкость;
µ Cv – молярная изохорная теплоёмкость;
µ Cр – молярная изобарная теплоёмкость.
Для определения соотношения между Cv и Cр рассмотрим процессы нагревания 1 кг идеального газа на 1 К при постоянном объёме и при постоянном давлении (рис. 5).
|
|
|

|
| Рис. 5. К определению соотношения между Cp и Cv. |
Количество теплоты, подведённое к 1 кг газа в изохорном процессе,
qv = m · Cv ·(t 2 – t 1) = Cv = Δ u, (2.15)
а количество теплоты, подведённое к 1 кг газа в изобарном процессе,
qp = m · Cp ·(t 2 – t 1) = Cp = Δ u + l. (2.16)
Вычтя из выражения (2.16) выражение (2.15), получим
qp – qv = Cp – Cv = l. (2.17)
Следовательно, разность между Cp и Cv равна работе 1 кг идеального газа при нагревании его на 1 К в процессе при постоянном давлении, а эта работа равна удельной газовой постоянной R:
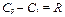 . (2.18)
. (2.18)
Полученное выражение (2.18) называется уравнением Майера. Если обе части уравнения (2.18) умножить на молярную массу, получим
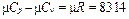 , Дж/(кг·К). (2.19)
, Дж/(кг·К). (2.19)
В теплотехнических расчётах часто используется отношение изобарной Cp и изохорной Cv теплоёмкостей
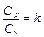 , (2.20)
, (2.20)
называемое коэффициентом Пуассона, или показателем адиабаты.
Для идеального газа k не зависит от параметров его состояния, а зависит только от вида газа и определяется числом степеней свободы его молекулы. Для одноатомных газов k = 1,67, для двухатомных k = 1,4, для трёх- и многоатомных газов k = 1,33.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 510; Нарушение авторских прав?; Мы поможем в написании вашей работы!