
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Плотность газовой смеси. Кажущаяся (средняя) молярная масса смеси
|
|
|
|
Закон Дальтона. Способы задания состава газовой смеси
Смеси идеальных газов
Идеальной газовой смесью называется смесь газов, не вступающих в химические реакции между собой, в которой каждый газ является идеальным и подчиняется законам идеальных газов.
Пусть в сосуде под давлением Р см находится смесь, состоящая из двух идеальных газов при температуре t см (рис. 6).

| Рис. 6. К определению давления смеси идеальных газов. |
Если один из газов удалить, то останется один газ при давлении Р 1. Если оставить только второй газ, то в сосуде установится давление Р 2. Следовательно, каждый газ в смеси создает своё давление, которое называется парциальным (от латинского partialis – частичный).
Парциальное давление – давление, которое оказывал бы газ – компонент газовой смеси на стенки сосуда, если бы он один занимал весь объём газовой смеси при той же температуре.
Тогда общее давление газовой смеси определится из выражения
 , (3.1)
, (3.1)
где Рi – парциальное давление i -го компонента газовой смеси.
Равенство (3.1) представляет собой математическое выражение закона Дальтона, который гласит: общее давление газовой смеси равно сумме парциальных давлений ее компонентов.
Состав газовой смеси может быть задан несколькими способами
1) массовыми долями;
2) объёмными долями;
3) молярными долями.
Массовой долей i -го компонента газовой смеси gi называется отношение массы данного компонента к массе всей смеси:
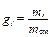 , (3.2)
, (3.2)
где mi – масса i -го компонента газовой смеси;
m см – масса газовой смеси.
Сумма масс всех компонентов mi, входящих в газовую смесь, равна массе смеси m см:
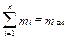 , (3.3)
, (3.3)
а сумма массовых долей gi всех компонентов равна единице:
|
|
|
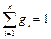 . (3.4)
. (3.4)
Объёмной долей i -го компонента газовой смеси ri называется отношение парциального объёма данного компонента к объёму всей смеси:
 , (3.5)
, (3.5)
где Vi – парциальный объём i -го компонента газовой смеси;
V см – объём газовой смеси.
Парциальным объёмом компонента газовой смеси Vi называется объём, который он занимает при давлении и температуре смеси.
Сумма парциальных объёмов всех компонентов Vi, входящих в газовую смесь, равна объёму газовой смеси V см:
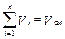 , (3.6)
, (3.6)
а сумма объёмных долей ri всех компонентов равна единице:
 . (3.7)
. (3.7)
Парциальный объём i -го компонента смеси Vi и объём газовой смеси V см в выражении (3.5) можно представить как произведение
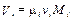 ,
, 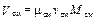 , (3.8)
, (3.8)
где Mi и M см – соответственно количество молей (киломолей) i -го компонента смеси и всей газовой смеси.
Тогда выражение (3.5) примет вид
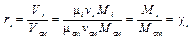 , (3.9)
, (3.9)
где отношение числа молей i -го компонента смеси Mi к числу молей всей газовой смеси M см называется молярной долей i -го компонента и обозначается  .
.
Как видно из полученного равенства (3.9), задание состава смеси объёмными и молярными долями тождественно, поэтому на практике используются только два первых способа задания состава газовой смеси – массовыми и объёмными долями.
При необходимости перехода от массового состава смеси к объёмному и обратно используются следующие зависимости:
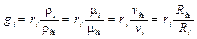 , (3.10)
, (3.10)
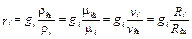 . (3.11)
. (3.11)
Плотность газовой смеси можно представить как отношение массы смеси к её объёму:
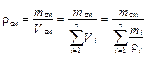 . (3.12)
. (3.12)
Подставив в выражение (3.12) mi из отношения
 , (3.13)
, (3.13)
окончательно для плотности газовой смеси получим
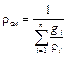 . (3.14)
. (3.14)
Выражение (3.14) используется в случае, если известен массовый состав газовой смеси. Если состав газовой смеси задан объёмными долями, то плотность смеси находят из выражения
 . (3.15)
. (3.15)
При расчетах, производимых с газовыми смесями, используют среднюю (кажущуюся) молярную массу, которая дает возможность рассматривать газовую смесь как один однородный газ, что существенно упрощает расчеты. Средняя молярная масса газовой смеси определяется как отношение массы газовой смеси к числу молей (киломолей) в смеси.
|
|
|
Массу газовой смеси можно представить как сумму масс ее компонентов:
 , (3.16)
, (3.16)
или
 . (3.17)
. (3.17)
Разделив левую и правую части на М см, получим
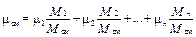 , (3.18)
, (3.18)
откуда окончательно имеем
 . (3.19)
. (3.19)
Количество молей газовой смеси можно представить как сумму молей компонентов смеси:
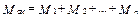 , (3.20)
, (3.20)
или
 . (3.21)
. (3.21)
Разделив левую и правую части равенства (3.21) на m см, получим
 . (3.22)
. (3.22)
С учётом того, что
 , (3.23)
, (3.23)
получим
 , (3.24)
, (3.24)
или
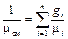 . (3.25)
. (3.25)
Окончательно для средней молярной массы газовой смеси имеем
 . (3.26)
. (3.26)
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3157; Нарушение авторских прав?; Мы поможем в написании вашей работы!