
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Электрохимические конденсаторы
|
|
|
|
NaBH4, NaOH, H2O, уголь | КОН (30% масс.) | уголь,воздух
Pt– катализатор Pt-Pd – катализатор
Рабочее напряжение U = 0.7 В, плотность тока I = 0.1 А/см2.
Анодная реакция BН4- + 8OH- → BO2- + 6Н2О +8е
Катодная реакция 2О2 + 4Н2О + 8е→ 8OH-
Суммарная реакция BН4- + 2О2 → BO2- + 2Н2О
Топливом (восстановителем) может являться водород Н2, гидриды (борогидрид NaBH4, алюмогидрид NaAlH4), металлы (алюминий, магний), смесь Н2 + СО (генераторный газ, конверсионный газ, водяной газ), спирты (метанол, этанол), углеводороды и даже твердый уголь. Окислитель – воздух, кислород или обогащенный кислородом воздух.
Хотя принципиально схема ТЭ очень проста, электрохимические реакции и процессы массопереноса исключительно сложны. Поэтому многие проблемы еще не решены, несмотря на полуторовековую историю ТЭ. Для специальных целей, особенно в космонавтике, ТЭ применяют с 1970-х годов. В последние годы были разработаны схемы ТЭ с твердым полимерным электролитом, работающие при обычной температуре. Надежность ТЭ повысилась до такой степени, что они могут конкурировать с другими источниками электроэнергии. Предполагается, что в ХХI веке именно ТЭ станут основными автономными ХИТ.
Конденсатор – это устройство, накапливающее электрическую энергию. ХИТ – это тоже устройство, накапливающее электрическую энергию. В чем различие между ними? Конденсатор характеризуется определенной постоянной емкостью:
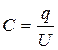 ,
,
измеряемой в Фарадах, 1 Ф = Кл/В. Запишем эту основную формулу по другому:
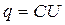
т.е. чем больше емкость, тем больше накапливаемый заряд при одном и том же напряжении. Если мы будем вести заряд и разряд постоянным током I, то получаем
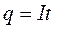
следовательно
|
|
|
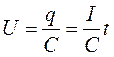
Напряжение на конденсаторе будет линейно меняться во времени с тангенсом угла наклона, равным I/C. Чередуя заряд – разряд, получим пилообразное изменение напряжения, как на этом рисунке.
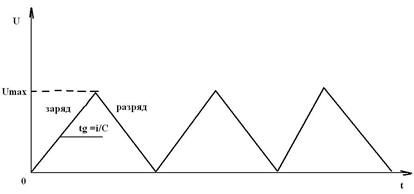
То есть форма разрядной и зарядной кривых конденсатора отличается от ХИТ (аккумулятора). Это определено принципиальной причиной. Заряд и разряд аккумулятора обусловлен электрохимической реакцией, которая протекает при приблизительно постоянном напряжении (при приблизительно постоянном потенциале). Заряд же и разряд конденсатора обусловлены накоплением электростатической энергии в соответствии с формулами, приведенными выше. По этой же причине скорость заряда и разряда конденсатора может на многие порядки превышать соответствующие скорости для аккумулятора, которые резко ограничены скоростью химических и фазовых превращений электродных веществ.
Максимальная энергия, накапливаемая конденсатором, вычисляется по формуле:
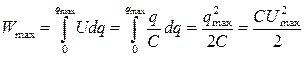
Рассмотрим виды электрохимических конденсаторов.
- Электролитические конденсаторы
Известны несколько десятков лет. Изготавливаются анодированием алюминиевой, танталовой, ниобиевой или титановой фольги, в результате чего она покрывается тонким диэлектрическим слоем оксида. Вторая обкладка конденсатора – электролит. Электролитические конденсаторы только по способу изготовления связаны с электрохимией.
Al │ Al2O3 (0.1 – 0.3 мкм) │ электролит
также Ta2O5, Nb2O5, TiO2
Напряжение пробоя оксида ~ 107 В/см. Рабочее напряжение конденсатора может быть до ~ 103 Вольт.
- Двойнослойные конденсаторы (ДСК).
Первый патент получен в 1957 года. Это уже настоящие электрохимические конденсаторы. Основаны на использовании емкости двойного электрического слоя (ДЭС), существующего на границе электрод | электролит. Емкость ДЭС в водных растворах составляет ~20 мкФ/см2 = 0.02 Ф/см2.
В ДСК два пористых поляризуемых электрода находятся в инертном электролите. Материал электродов – обычно различные виды углерода: активированный уголь, углеродная ткань, стеклоуглерод, углеродный аэрогель, графит и д.р. Электролит – водные растворы простых устойчивых ионогенных соединений, таких как NaCl, KOH, H2SO4, NaF и др. При типичной площади поверхности активированного угля 1000 – 3000 м2/г, получаем емкость 20 – 60 Ф/г. По сравнению с обычными конденсаторами – это гигантские величины. Циклируемость 105 – 106 циклов. Напряжение – низкое, обычно ±1 В. С органическими электролитами (например, растворитель ПК) получается больше, например ±2.5 В. Габариты ДСК самые разные, вес от 1 грамма до десятков килограмм.
|
|
|
- Псевдоконденсаторы (ПсК) или суперконденсаторы на основе псевдоемкости
Эти варианты уже ближе к перезаряжаемым ХИТ. Содержат два твердых электрода, которые могут быть одинаковыми. Заряд накапливается в них за счет фарадеевского процесса достаточно обратимой редокс-реакции, плюс добавляется емкость ДЭС. Поэтому емкость получается значительно больше, чем у ДСК.
Например, используется внедрение (и обратная экстракция) ионов водорода в гидроксид рутения HRuO2
(+) HRuO2 ↔ H1-xRuO2 + x H+ + x e
(–) HRuO2 + x H+ + x e ↔ H1+xRuO2
Суммарная реакция: HRuO2 ↔ H1-хRuO2 + H1+хRuO2
- Гибридные конденсаторы (ГК)
Представляют собой переходный вариант между аккумулятором и конденсатором. В ГК один электрод взят от ХИТ, а другой – от конденсатора. Например:
NiOOH│KOH│C
Причины разработки электрохимических конденсаторов.
Зачем нужны ДСК и другие электрохимические конденсаторы? Основная причина их разработки – необходимость иметь энергетические устройства С СУЩЕСТВЕННО БОЛЕЕ ВЫСОКОЙ ЦИКЛИРУЕМОСТЬЮ И УДЕЛЬНОЙ МОЩНОСТЬЮ по сравнению с аккумуляторами.
ДСК и другие электрохимические конденсаторы заполнили пустую до того нишу между конденсаторами и аккумуляторами. Сейчас типично, что суперконденсатор подключают параллельно аккумулятору, и он берет на себя пиковые нагрузки, например, при запуске двигателя внутреннего сгорания. Это существенно удлиняет срок службы стартерного аккумулятора. Особенно велико преимущество ДСК при низкой температуре –20 … –50°С. Это обусловлено малой чувствительностью электростатического заряда к температуре.
|
|
|
В таблице сравниваются типичные характеристики конденсаторов и аккумуляторов.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 626; Нарушение авторских прав?; Мы поможем в написании вашей работы!