
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Основы квантовой механики. Уравнение Шредингера
|
|
|
|
Вся совокупность сведений о свойствах света заставляет признать, что свет обладает одновременно и корпускулярными, и волновыми свойствами, причем в одних явлениях в большей степени проявляются корпускулярные свойства света, в других (интерференция, дефракция, дисперсия, поляризация) – волновые. Явно проявляется закономерность: чем короче длина волны, тем ярче проявляются квантовые (корпускулярные) свойства; чем больше длина волны, тем ярче проявляются волновые свойства света.
Вывод: противоречивые корпускулярные и волновые свойства даны в их неразрывном единстве, в органической слитности и представляют диалектическое единство. В синтезе волновых и корпускулярных свойств света мы видим, что в каждом явлении природы проявляются противоположности и что вместе с тем существует их диалектическое единство.
Выражением корпускулярно-волнового дуализма, лежащего в основе, существе самой природы света – двойственности его свойств, является существование прямой связи между корпускулярными и волновыми характеристиками света: Е = hn, но Е = mc2, mc2 = hn,
mc = 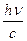 =
= 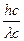 , mc =
, mc = 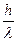 , l =
, l = 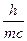 .
.
В 1924 году корпускулярно-волновой параллелизм оптики французский физик Луи де Бройль распространил на электроны, атомы и молекулы, сопоставив с движением каждой частицы некоторую волну, характеризующую ее волновые свойства. Между этой длиной волны и импульсом частиц mV де Бройль установил соотношение:
l = 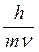 .
.
Уравнение Шредингера для стационарных состояний (не содержит времени):
Dy + 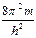 [E - Епот (x,y,z)] y = 0
[E - Епот (x,y,z)] y = 0
Движение микрочастиц описывается уравнением Шредингера. Это уравнение имеет требуемые (т. е. однозначные, конечные и непрерывные) решения в следующих случаях:
|
|
|
1) любых положительных значениях Е;
2) дискретных отрицательных значениях энергии, равных:
E = - 
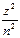 , где n = 1, 2, 3,...
, где n = 1, 2, 3,...
Случай Е > 0 соответствует электрону, пролетающему вблизи ядра и удаляющемуся вновь на бесконечность. Случай Е<0 соответствует электрону, находящемуся в пределах атома.
Собственные функции y уравнения (7.5) содержат четыре целочисленных параметра, которые принято называть квантовыми числами. Введение квантовых чисел обусловлено тем, что электрон одновременно является и частицей, и волной, а потому его местоположение в атоме в точности указать принципиально невозможно. И хотя для наглядности введены орбиты электронов, на самом деле их нет. Можно говорить только о вероятности нахождения электрона в той или иной точке атомного объема. Часть пространства атома, где вероятность нахождения электрона максимальна, называется электронной орбиталью. (Термин «орбиталь» заменил слово «орбита» и во многом – слово «оболочка»). Таким образом, орбиталью считается замкнутая, поверхность, внутри которой пребывание определенного электрона наиболее вероятно. Говорят, что внутри этой поверхности сосредоточена большая часть электронной плотности. Орбитали наружных электронов могут сливаться.
Энергия же, с которой электроны, находящиеся, на орбитали, взаимодействуют с ядром атома, определяется точно, так как в данном случае электрон проявляет свойства частицы.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 243; Нарушение авторских прав?; Мы поможем в написании вашей работы!