
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Влияние конкурирующей реакции осадкообразования на потенциал
|
|
|
|
Одна из форм образует осадок.
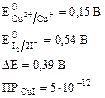
Согласно стандартным потенциалам, окислителем является пара йода и должна пойти реакция:

Но эта реакция не идет из-за протекания конкурирующей реакции осадкообразования
Уравнение Нернста для пары меди
ЕСu2+/Cu+ = EoCu2+/Cu+ +  lg
lg 
Cu+ + J- = CuJ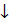
Абсолютно нерастворимых осадков нет.
ПРCuJ = [Cu+][J-] [Cu+] = 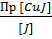
ЕСu2+/Cu+ = EoCu2+/Cu+ -  IgПР +
IgПР +  lg [Cu2+] [J-]
lg [Cu2+] [J-]
Ео Cu2+/CuJ = EoCu2+/Cu+ -  IgПР = 0,86v
IgПР = 0,86v
Ео Cu2+/CuJ > EoJ2/2J-
0,86v > 0,54v
Пара меди является окислителем по отношению к паре йода. В реальных условиях протекает следующая реакция
Cu2+ + J- = 2CuJ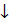 + J2
+ J2
Cu2+ + J- + 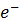 = CuJ
= CuJ
2J- - 2e  J2
J2
Влияние конкурирующей реакции комплексообразования на величину окислительно-восстановительного потенциала.
Бихроматометрическое определение железа (II) (титриметрический метод).
Для выполнения определения необходима достаточно большая разность потенциалов систем бихромата и железа. Для создания таких условий вводят «защитную смесь» (смесь серной и фосфорной кислот). Для увеличения разности потенциалов нужно увеличить потенциал системы бихромата и уменьшить потенциал системы железа.
Для увеличения потенциала системы бихромата приливают серную кислоту (не соляную, потому что она имеет восстановительные свойства).
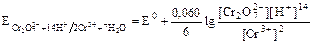
Потенциал увеличивается при увеличении концентрации ионов водорода (серная кислота).
Для уменьшения потенциала системы железа вводится фосфорная кислота, которая связывает ионы 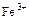 в фосфатный комплекс
в фосфатный комплекс  , т.е идет конкурирующая реакция комплексообразования.
, т.е идет конкурирующая реакция комплексообразования.
 ,
,  что приводит к уменьшению окислительно-восстановительного потенциала системы железа. Высокая разность потенциалов необходима для того, чтобы можно было зафиксировать точку эквивалентности с индикатором дифениламином.
что приводит к уменьшению окислительно-восстановительного потенциала системы железа. Высокая разность потенциалов необходима для того, чтобы можно было зафиксировать точку эквивалентности с индикатором дифениламином.
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 876; Нарушение авторских прав?; Мы поможем в написании вашей работы!