
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности углерод-углеродных связей
|
|
|
|
Одной из причин многообразия органических веществ является способность атома углерода к образованию различных типов углерод-углеродных связей.
Электронная конфигурация углерода 1s22s22p2, т. е. атом углерода имеет два неспаренных p-электрона, которые могут принимать участие в образовании двух ковалентных связей. Однако известно, что углерод, как правило, образует четыре ковалентные связи. Это объясняется тем, что при образовании ковалентных связей один из 2s-электронов переходит на свободную p-орбиталь, в результате чего появляются четыре неспаренных электрона, которые могут образовать четыре ковалентные связи с другими атомами. Но при этом одна из них будет образована за счет сферического s-электронного облака, а три – за счет p-облаков, имеющих форму гантели.
|

Экспериментально установлено, что в молекулах предельных углеводородов все связи атомов углерода равноценны. Это можно объяснить с привлечением представлений о гибридизации электронных облаков. Согласно теории гибридизации (Л. Полинг, 1931), в образовании химической связи могут принимать участие гибридные (комбинированные) электронные облака, форма которых отличается от форм исходных облаков.
sp3-гибридизация. В этом случае гибридные облака формируются за счет одного s- и трех p-облаков. Доля сферической s-орбитали в общей электронной плотности невелика, поэтому четыре гибридных облака имеют форму немного несимметричной восьмерки. Электронные облака одноименно (отрицательно) заряжены и стремятся максимально удалиться друг от друга, что достигается при их ориентации в пространстве в направлении от центра к вершинам тетраэдра (рис. 1). Углы между осями гибридных электронных облаков составляют 109º28/. Подобным расположением химических связей
|
|
|

Рис. 1. sp3- гибридизованные орбитали
атомов углерода обусловлена зигзагообразная форма углеродных цепей предельных углеводородов и тетраэдрическое строение простейшего алкана – метана.
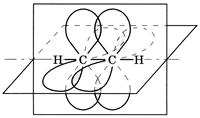
sp2-гибридизация. Этот тип гибридизации орбиталей реализуется при комбинации одной s- и двух p-орбиталей. Образующиеся три sp2-орбитали лежат в одной плоскости и образуют углы 120º (рис. 2). Доля s-орбитали в гибридной орбитали увеличивается, поэтому sp2-орбиталь представляет собой восьмерку, одна из долей которой короче и толще, чем в sp3-орбитали; атомный объем уменьшается. Облако одного из p-электронов, не участвующего в гибридизации, имеет форму симметричной относительно ядра восьмерки и располагается перпендикулярно плоскости, в которой находятся гибридные орбитали. При взаимодействии sp2-углеродных атомов расширяются возможности перекрывания их орбиталей: наряду с перекрыванием по линии, соединяющей ядра атомов (образование σ-связи) возможно боковое перекрывание негибридных орбиталей (образование π-связи). Такая связь называется двойной связью и представляет собой комбинацию σ- и π-связей (рис. 3). Поскольку объем sp2-углеродного атома меньше объема sp3-гибридного углерода, соответственно и длина двойной связи будет меньше, чем длина одинарной.
 | |||
 | |||
Рис. 2. sp2- гибридизованные Рис. 3. Пространственное расположе-
орбитали ние орбиталей в молекуле этилена
sp-гибридизация. В гибридизации участвуют лишь две орбитали атома углерода (s- и p-). Форма гибридной орбитали еще более приближается к шарообразной, атомный объем становится еще меньше. Две гибридные орбитали, стремясь максимально удалиться друг от друга, образуют с другими атомами связи, ориентированные под углом 180º. Две другие p-орбитали атома углерода не участвуют в гибридизации и при боковом перекрывании с подобными орбиталями другого sp-гибридного углерода образуют π-связи, расположенные во взаимно перпендикулярных плоскостях (рис. 4). Возникаю-
|
|
|
 |
а б
Рис. 4. sp-гибридизованные орбитали (а) и пространственное
расположение орбиталей в молекуле ацетилена (б)
щая при этом химическая связь носит название тройной связи – это комбинация одной σ- и двух π-связей. Атомный объем sp-гибридного углерода меньше, чем sp2-гибридного, поэтому тройная связь должна быть короче двойной, а ее энергия – больше. Данные о различных типах углерод-углеродных связей приведены в табл. 1.2.
Таблица 1.2. Сравнительная характеристика углерод-углеродных связей
| Тип связи | Тип гибридизации | Длина связи, нм | Угол между гибридными орбиталями | Энергия связи, кДж/моль | Форма молекулы |
| | | —C—C— | | | sp3 | 0,154 | 109º28/ | тетраэдри- ческая | |
| >C=C< | sp2 | 0,134 | 120º | плоская | |
| —C≡C— | sp | 0,120 | 180º | линейная |
Длина связи – среднее расстояние между ядрами атомов.
Энергия связи – энергия, которую необходимо затратить для разрыва химической связи.
Простой расчет показывает, что на долю π-связи в двойной связи приходится (605 – 350) = 255 кДж/моль, что свидетельствует о том, что боковое перекрывание орбиталей менее эффективно, чем линейное. На долю каждой из π-связей в тройной связи приходится еще меньше [(825 – 350): 2] = 237,5 кДж/моль. Из этого можно сделать вывод, что π-связи в молекуле наиболее слабые, следовательно, в первую очередь будут подвергаться разрушению в химических превращениях.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 5351; Нарушение авторских прав?; Мы поможем в написании вашей работы!