
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Адсорбционные методы
|
|
|
|
Метод хемосорбции
Он основан на поглощении газов и паров твердыми или жидкими поглотителями с образованием малолетучих или малорастворимых соединений. Большинство реакций, протекающих в процессе хемосорбции, являются экзотермическими и обратимыми, поэтому при повышении температуры раствора образующееся химическое соединение разлагается с выделением исходных элементов. Поглотительная способность хемосорбента почти не зависит от давления, поэтому хемосорбция более выгодна при небольших концентрациях вредностей в отходящих газах.
Примером хемосорбции может служить очистка от сероводорода с использованием мышьяковощелочного раствора:
Na4As2S5O2 +H2S = Na4As2S6O +H2O
Регенерация раствора проводится окислением продукта кислородом, содержащимся в очищаемом воздухе:
Na4As2S6O + 1/2O2 = Na4As2S5O2 + S2
В этом случае в качестве побочного продукта получается сера.
От сероводорода можно очищать газ и с применением раствора едкого натра. Получаемый при этом гидросульфид натрия можно использовать для очистки сточных вод от металлов:
H2S + NaOH = NaHS + H2O
На мокром улавливании основано также производство некоторых редких металлов, таких как индий, кадмий, и др. В данном случае, например, при производстве цинка индий переходит в возгоны, т.е. в газ, который затем улавливается как в дистиллировочном аппарате. Эти возгоны собирают, которые затем служат полупродуктом для производства металла.
Но мокрые способы очистки газов имеют и недостатки. При очистке получают разбавленные растворы и шламы, которые затем нужно куда-то утилизировать. Кроме этого из-за высокой коррозионной активности газов и полученных растворов оборудование приходится делать в коррозиостойком исполнении и по возможности герметичным, что удорожает стоимость этого оборудования.
|
|
|
Адсорбция – диффузионный процесс, в котором происходит взаимодействие между газом и поверхностью твердых тел. Адсорбционные методы используют для очистки газов с невысоким содержанием газообразных и парообразных примесей. Различают физическую и химическую адсорбцию (хемосорбцию).
В качестве адсорбентов используют пористые материалы синтетического и природного происхождения с высокоразвитой внутренней поверхностью:
- активные угли;
- селикагели – гидратированные аморфные кремнеземы (SiO2.nH2O);
- алюмогель – активный оксид алюминия (Al2O3.nH2O), получаемый прокаливанием различных гидроксидов алюминия;
- цеолиты – алюмосиликаты, содержащие в своем составе оксиды щелочных и щелочно-земельных металлов;
- иониты - высокомолекулярные соединения.
Регенерацию насыщенных адсорбентов осуществляют либо нагревом насыщенного адсорбента до температуры, превышающей рабочую, либо продувкой его паром или горячим газом.
Основные закономерности, протекающие при адсорбции газов, носят те же закономерности, что и для жидкости. Эти закономерности были рассмотрены ранее, поэтому в данной части на них останавливаться не будем.
Конструктивно адсорберы выполняются в виде вертикальных, горизонтальных либо кольцевых емкостей, заполненных пористым адсорбентом, через который фильтруется поток очищаемого газа. Фильтрация газа происходит через неподвижный (адсорберы периодического действия) или движущийся слой адсорбента. Наибольшее распространение получили адсорберы периодического действия, в которых период контактирования очищаемого газа с твердым адсорбентом чередуется с периодом регенерации адсорбента.
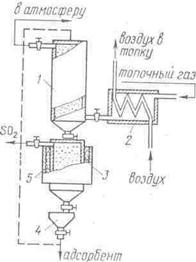
На рис. 43 представлена схема адсорбционной установки для удаления SO2 из горячего топочного газа. Основным агрегатом установки служит адсорбер 1, который заполнен древесным активированным углем. Горячий топочный газ проходит теплообменник 2, подогревает воздух, поступающий в топку, и подается в нижнюю часть адсорбера, где при температуре 150-200оС происходит улавливание сернистого газа. Очищенный дымовой газ выбрасывается в атмосферу через дымовую трубу. Адсорбент после насыщения переходит в десорбер 5, где с помощью подогревателя 3 поддерживается температура 300-600оС. Богатый оксидом серы газ выводится из десорбции и может быть направлен на получение серной кислоты каталитическим методом. Регенерированный адсорбент поступает в бункер 4 и затем с помощью ковшового элеватора поступает в верхнюю часть адсорбера.
|
|
|
|
Рис. 43. Адсорбционная установка для удаления оксида серы из горячего топочного газа:
1 – адсорбер; 2 – теплообменник; 3 – подогреватель; 4 – бункер; 5 – десорбер.
Методы каталитической очистки газов. Суть каталитических процессов газоочистки заключается в химическом преобразовании подлежащих обезвреживанию примесей в другие продукты в присутствии специальных катализаторов, роль которых сводится к увеличению скорости химических взаимодействий. Катализатор обеспечивает взаимодействие на его поверхности преобразуемых веществ, образование промежуточных поверхностных соединений катализатора и реагирующих веществ с последующим формированием продуктов катализа и восстановлением поверхности катализатора. В качестве катализаторов используют металлы платиновой группы (платина, палладий, рутений, родий) или более дешевые, но менее эффективные и стабильные в эксплуатации составы, включающие никель, хром, медь, цинк, ванадий, церий и другие элементы. Катализаторы обычно выполняются в виде шаров, колец или проволоки, свитой в спираль.
Существенное влияние на скорость и эффективность каталитического процесса оказывает температура газов. Для каждой реакции, протекающей в потоке газа, характерна, так называемая минимальная температура начала реакции, ниже которой катализатор не проявляет активности. Для поддержания необходимой температуры газа иногда к нему подмешивают продукты сгорания от вспомогательной горелки, работающей на каком-либо высококалорийном топливе.
|
|
|
На рис. 44 представлен каталитический реактор, предназначенный для окисления толуола, содержащегося в газовоздушных выбросах цехов окраски. Воздух, содержащий примеси толуола, подогревается в межтрубном пространстве теплообменника-рекуператора 1, откуда по переходным каналам он поступает в подогреватель 4. Продукты сгорания природного газа, сжигаемого в горелках 5, смешиваются с воздухом, повышая его температуру до 250- 350оС, то есть до уровня, обеспечивающего оптимальную скорость окисления толуола на поверхности катализатора. Процесс химического превращения происходит на поверхности катализатора 3, размещенного в контактном устройстве 2. В качестве катализатора применяют природную марганцевую руду (пирполюзит) в виде гранул размером 2-5 мм, промотированных азотнокислым палладием. В результате окисления окисления толуола образуются нетоксичные продукты: оксид углерода и водяные пары:
С7Н8 + 9 О2 = 7 СО2 + 4 Н2О.
Смесь воздуха и продуктов реакции при температуре 350-450оС направляется в рекуператор 1, где отдает тепло газовоздушному потоку, идущему на очистку, а затем через выходной патрубок выводится в атмосферу.
Очищенный газ

|
топливо газ
Рис. 44. Каталитический реактор:
1 – теплообменник-рекуператор; 2 – контактное устройство; 3 – катализатор; 4 – подогреватель; 5 – горелка.
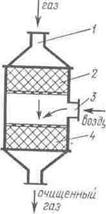
В последние годы каталитические методы очистки нашли применение для нейтрализации выхлопных газов автомобилей. Для комплексной очистки выхлопных газов – окисления продуктов неполного сгорания и восстановления оксида азота – применяют двухступенчатый каталитический нейтрализатор (рис. 45). Установка состоит из последовательно соединенных восстановительного 2 и окислительного 4 катализаторов. Отработавшие газы через патрубок 1 поступают к восстановительному катализатору 2, на котором происходит нейтрализация окисдов азота:
NО + СО → ½ N2 + CO2,
NО + H2 → ½ N2 + H2O.
В качестве восстановительного катализатора применяют монельметалл (медноникелевый сплав) или катализатор из благородных металлов (платина на глиноземе).
|
|
|
После восстановительного катализатора к отработавшим газам для создания окислительной среды через патрубок 3 подводится вторичный воздух. На окислительном катализаторе происходит нейтрализация продуктов неполного сгорания – оксида углерода и углеводов:
СО + ½ O2 → CO2,
СхНу + (х + у/4) O2 → хCO2 + у/2H2O.
Для окислительных процессов применяют катализатор из благородных металлов или оксидов переходных металлов (медь, никель, хром и др). Содержание оксида углерода в выхлопных газах при этом уменьшается в 10 раз, а углеводов – в 8 раз.
Широкому применению каталитических нейтрализаторов препятствует использование этилированного бензина, который содержит определенное количество свинца. Свинец дезактивирует катализаторы в течение 100-200 ч.
|
Рис. 45. Двухступенчатый каталитический нейтрализатор:
1 – патрубок для ввода выхлопных газов; 2 – восстановительный катализатор; 3 – патрубок для ввода вторичного воздуха; 4 – окислительный катализатор.
Каталитические методы используются и при производстве серной кислоты для окисления сернистого газа до серного ангидрида. В качестве катализатора используется специальный ванадиевый катализатор. При этом сконцентрированный методами адсорбции сернистый газ пропускают через катализатор. Добавляют воду и получают серную кислоту:
2SO2 + 2H2O + O2 + ванадиевый катализатор = 2H2SO4
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3167; Нарушение авторских прав?; Мы поможем в написании вашей работы!