
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химические свойства фенолов. Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C6H5—OH
|
|
|
|
Фенолы
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C6H5—OH.
Физические свойства фенола: твердое бесцветное вещество с резким запахом; ядовит; при комнатной температуре заметно растворим в воде, водный раствор фенола называют карболовой кислотой.
1. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только с щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
2C6H5OH + 2Na 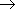
| 2C6H5ONa | + H2 |
| фенолят натрия |
2. Взаимодействие с щелочами:
C6H5OH + NaOH  C6H5ONa + H2O
C6H5ONa + H2O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
3. Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной  - системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто - и пара -положения) и уменьшается у 3-го и 5-го атомов углерода (мета -положение).
- системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто - и пара -положения) и уменьшается у 3-го и 5-го атомов углерода (мета -положение).
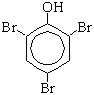
а) Реакция с бромной водой (качественная реакция):
| + 3Br2 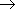
| 
| + 3HBr |
Образуется 2,4,6-трибромфенол - осадок белого цвета.
б) Нитрование (при комнатной температуре):
C6H5—OH + HNO3(разб.)  H2O + O2N—C6H4—OH (смесь орто - и пара -изомеров)
H2O + O2N—C6H4—OH (смесь орто - и пара -изомеров)

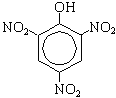
| + 3HNO3(конц.)  3H2O + 3H2O +
| 
|
По второй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
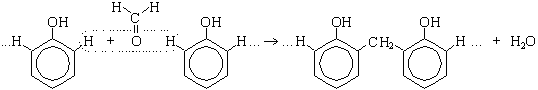
4. Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
|
|
|
5. Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 885; Нарушение авторских прав?; Мы поможем в написании вашей работы!