
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Решение уравнения Шредингера
|
|
|
|
УРАВНЕНИЕ ШРЕДИНГЕРА
Шрёдингер выбрал математическое описание стоячей волны в качестве модели для строения атома. Он включил в выражение для стоячей волны предположение де Бройля l=h/mJ и получил
Ñ2y + (4p2m2J2/h2)y == 0.
Комбинируя уравнения с уравнением, связывающее полную энергию Е, потенциальную энергию V и кинетическую энергию mJ2/2.
Е = V + mJ2/2 или J2 = 2 (Е — V)/m,
можно получить уравнение Шрёдингера в его обычной форме
Ñ2y +(8p2m/h2)(E-V)=0
Следует помнить, что уравнение Шредингера не выводится из более общих законов, а является следствием, во-первых, эмпирического выбора уравнения для стоячей волны в качестве модели для описания поведения -электрона в атоме и, во-вторых, включения в последнее гипотезы де Бройля. Обоснованием такого «вывода» является тот факт, что решение уравнения приводит к значениям энергии Е, точно соответствующим найденным экспериментально из атомных спектров
Остановимся на смысле символа y в уравнении Шредингера. Поскольку y является трехмерным аналогом А (амплитуды плоской волны), y рассматривается как амплитудная функция. Самой функции y нельзя приписать физический смысл, но такой смысл имеет величина yy*, которая, как можно показать, пропорциональна вероятности нахождения электрона в данном положении (y* — это функция, комплексно сопряженная с y). Величина yy*dt передает вероятность нахождения электрона в элементе объема dt. Если y является действительной функцией, yy* переходит в y2.
Рассмотрим теперь качественно метод, используемый для решения уравнения Шредингера для случая атома водорода. Первым шагом является упрощение решения путем преобразования уравнения от декартовых координат (оси х, у и z) к сферическим полярным координатам.
|
|
|
При преобразовании системы координат уравнение Шредингера переходит в уравнение

(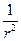 )(
)(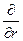 )(r2
)(r2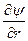 ) + (
) + (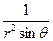 )(
)(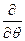 )(sinq
)(sinq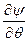 ) +
) +
. +(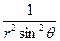 )(
)(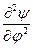 ) +
) + 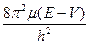 )y = 0
)y = 0
Здесь m — приведенная масса ' m = 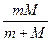 ,
,
где М— масса ядра, m—масса электрона.
Уравнение можно разделить на более простые уравнения, каждое из которых включает только одну переменную r, q или j и может быть решено независимо. Эти уравнения имеют бесконечное множество решений; но, для того чтобы решения имели смысл для описания поведения электрона в атоме, они должны удовлетворять изложенным ниже требованиям «а» — «в». Каждое возможное решение представляет собой волновую функцию y, описывающую орбиталь — состояние атома. Для выделения пригодных решений из бесконечного общего числа их нужно отобрать те, точки, что удовлетворяют следующим условиям:
а) волновая функция должна быть конечной и непрерывной т. е. она не должна обращаться в бесконечность ни при каких значениях r, q и j.
б) решение должно быть однозначным, т. е. в любой данной точке амплитуда может иметь только одно значение, а не несколько;
в) решения должны быть нормированы; это условие требует, чтобы взятый по всему пространству интеграл от функции (являющейся решением), возведенной в квадрат и умноженной на dt, был равен единице, т. е.
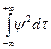 = 1
= 1
Поскольку y2dt связано с вероятностью нахождения электрона в элементе объема dt, интегрирование в уравнении просто требует, чтобы вероятность нахождения электрона где-либо в пространстве была равна единице.
Для неионизованного атома имеется лишь ограниченное число решений уравнения Шрёдингера, удовлетворяющих всем сформулированным выше требованиям. Такие дозволенные решения называются собственными функциями, и каждое из них описывает состояние — орбиталь, на которой в атоме могут находиться два электрона Орбитали отличаются нижними индексами при y; каждая орбиталь однозначно определяется набором квантовых чисел n,l и m, где n соответствует основному номеру оболочки Уравнения для ynp разделяются на радиальную часть yr (зависящую от расстояния г) и угловую часть yqj (являющуюся функцией углов q и j). Полная волновая функция представляет собой просто произведение этих двух частей, т. е. y=yqjyr.Выражения для s-орбиталей не включают никакой зависимости от углов, и поэтому они обладают сферической симметрией. Число решений указывает, сколько существует орбиталей с данной энергией (т. е. в данной оболочке с одним главным квантовым числом). Для орбитали, отвечающей оболочке с n=1 (т.е. оболочке с самой низшей энергией), возможно только одно решение y1s. Для значений энергии, соответствующих n=2, имеются два очень близких энергетических уровня, соответствующих волновым функциям y2s и y2p. Есть только одно решение для y2s и три решения для y2p, соответствующие трем орбиталям y2p0,y2p+1,y2p-1. Эти три 2р-орбитали имеют все одинаковую энергию. Для описания равенства энергий трех орбиталей используется термин «трижды вырожденные». Для энергий, отвечающих оболочке с п=3, имеется девять решений, соответствующих одной y3s-орбитали, трем вырожденным y3p-орбиталям и пяти вырожденным ysd-орбиталям. Решений, которые отвечали бы орбиталям y1p или y2d, нет, и таких орбиталей нет. Таким образом, выбрав в качестве модели стоячую волну, включив в волновое уравнение гипотезу де Бройля и отобрав физически приемлемые решения получившегося уравнения, можно сосчитать число возможных орбиталей в атоме водорода.
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 668; Нарушение авторских прав?; Мы поможем в написании вашей работы!