
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гидролиз
|
|
|
|
Лекция 5,6.
ПРИМЕР
Рассчитаем рН ацетатно-буферного раствора, в котором ссоли = скислоты= = 0,1
моль/л. В этом случае рН = рКд = 4,75. Если в этот раствор добавить НС1
концентрации 10-2 моль/л, то из-за реакции
Н+ + С1- + СНзСОО - = СНзСООН + С1-
концентрация соли уменьшится на 10 -2 моль/л, а концентрация кислоты
увеличится на 10-2 моль/л.
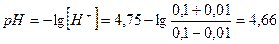
Как видно, рН изменилась незначительно (на 0,09 единицы).
Если бы это количество НС1 добавить в дистиллированную воду, то ее рН
изменилась бы от 7 до 2 (на 5 единиц).
Многие неорганические вещества, растворяясь в воде вступают с ней в химическую реакцию.
Обменная реакция между растворимым веществом и водой называется гидролизом.
Гидролизу подвергаются только растворимые соли, но не все.
Существует понятие сильной кислоты и сильного основания, т.е. те которые в воде диссоциируют полностью, например:
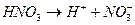
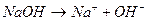
Слабая кислота
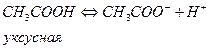
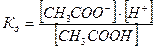
Слабое основание
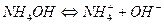
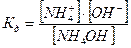
Соли, образованные сильной кислотой и сильным основанием не гидролизуются, их растворы нейтральны, рН = const при растворении = 7.
Соли, образованные катионом сильного основания и анионом слабой кислоты гидролизуются по аниону, например
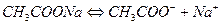
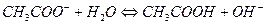
рН > 7, избыток ионов ОН-
Соли, образованные многоосновными слабыми кислотами и сильными основаниями гидролизуются ступенчато: например, Na2CO3
I ступень: 
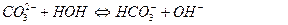
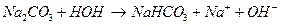

 II ступень:
II ступень: 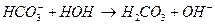
Н2О СО2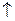
Гидролиз I ступени всегда преобладает.
Гидролиз обратим, эндотермичен (в этом случае).
Соли, образованные катионом слабого многоосновного основания и анионом сильной кислоты гидролизуются по катиону.
Например 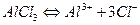
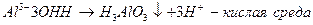
Гидролизу подвергаются соли, образованные катионом очень слабого основания и анионом очень слабой кислоты.
|
|
|
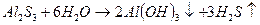
Гидролиз в данном случае необратим.
Соли, образованные катионом слабого основания и анионом слабой кислоты, например Cu (OOCCH3)2 гидролизуются по катиону и аниону.
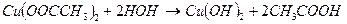
рН зависит от того, какой ион гидролизуется в большей степени, рН может быть как слабокислый, так и слабощелочной.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 300; Нарушение авторских прав?; Мы поможем в написании вашей работы!