
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Произведение растворимости. Условия образования и растворения осадка
|
|
|
|
Пример 2
Вычислить рН 0,1н раствора NH4Cl; 
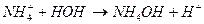
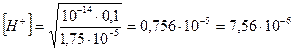

В насыщенном при данной температуре растворе малорастворимого электролита между кристаллами и раствором устанавливается динамическое равновесие.
При равновесии скорость растворения вещества и скорость его кристаллизации равны, т.е. при равновесии в насыщенном растворе малорастворимого электролита скорости прямого и обратного процессов равны.
Отношение константы скоростей есть константа равновесия, которая называется произведением растворимости.
Другими словами произведение растворимости – это константа гетерогенного равновесия между кристаллами малорастворимого электролита КхАу и его раствором

Например, для насыщенного раствора малорастворимой соли Са3(РО4)2 в отсутствие сильных электролитов

При значительной ионной силе раствора произведение растворимости выражается через активности ионов

Эффективная концентрация ионов называется активностью
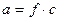
 - коэффициент активности
- коэффициент активности
 - функция ионной силы
- функция ионной силы

Если произведение концентраций ионов в степени их стехиометрических коэффициентов равно произведению растворимости, то раствор относится к насыщенным, если это произведение больше произведения растворимости – выпадает осадок, идет кристаллизация, если меньше произведения растворимости – растворение.
Пример: При комнатной температуре в 100 мл насыщенного раствора содержится  г гидроокиси цинка Zn(OH)2. Определить произведение растворимости гидроокиси цинка.
г гидроокиси цинка Zn(OH)2. Определить произведение растворимости гидроокиси цинка.
Решение
1. Определим растворимость гидроокиси цинка
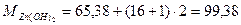 г/моль
г/моль
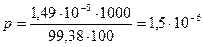 моль/л
моль/л
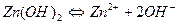
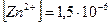 г-ион/л
г-ион/л
 г-ион/л
г-ион/л

Равновесие кристаллизации и растворения электролита подчиняется правилам смещения равновесия. При увеличении в насыщенном растворе концентрации одного из ионов равновесие смещается влево, т.е. в направлении процесса кристаллизации и наоборот, при уменьшении концентрации ионов равновесие смещается в сторону растворения.
|
|
|
Пример:
В условиях предыдущей задачи определить растворимость Zn(OH)2 в 0,001 М растворе ZnCl2
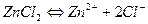
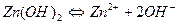
Х 0,001 2х


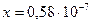 моль/л
моль/л
Растворимость Zn(OH)2 в растворе ZnCl2 составляет 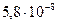 моль/л, т.е. растворимость уменьшается в
моль/л, т.е. растворимость уменьшается в 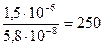 раз.
раз.
Введение в насыщенный раствор малорастворимого электролита другого, хорошо растворимого сильного электролита, не содержащего с ним одноименный ион, приводит к повышению растворимости (солевой эффект).
Повышение ионной силы раствора приводит к увеличению растворимости мало растворимых солей. Так, в морской воде растворимость многих малорастворимых в речной воде веществ заметно возрастает.
Растворимость некоторых слабых оснований может измениться при разных значениях рН, например Zn(OH)2; Al(OH)3 – амфотерные соединения.
В кислых растворах они ведут себя как щелочи, в щелочных – как кислоты.
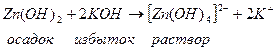
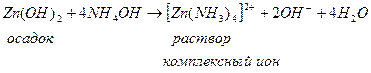
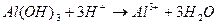

|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 773; Нарушение авторских прав?; Мы поможем в написании вашей работы!