
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Формирование малых периодов
|
|
|
|
Периодическая таблица Менделеева
Таблица состоит из 7 периодов. Первые три периода малые, последние четыре периода большие.
Физический смысл номера периода заключается в том, что номер периода соответствует главному квантовому числу.
Ёмкость первого энергетического уровня равна двум электронам (N=2), следовательно, первый период состоит из двух элементов:
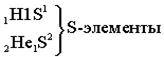
| S-элементами называют элементы, у которых заполняются электронами S-подуровни. |
Ёмкость второго энергетического уровня N = 8. Длина второго периода составляет 8 элементов.
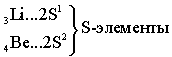

В силу первого закона Клечковского длина и строение третьего периода в точности повторяют второй: два S - элемента, шесть P - элементов.
Каждый период начинается с двух S – элементов, которые, за исключением водорода и гелия, являются самыми активными металлами.
Каждый период заканчивается активными неметаллами, за исключением благородных газов - химически инертых веществ.
Признаком металличности элементов является их способность терять свои валентные электроны.
| Ме0 - е | 
| Ме+ | реакция окисления |
| восстановитель |
Мера металличности элементов является мерой их восстановительной способности.
Металличность элементов имеет количественную характеристику - энергию ионизации
ЕI, эВ/ат.
Энергия ионизации – энергия, необходимая для отрыва электрона от атома.
Чем ниже эта энергия, тем более активным металлом является данный элемент.
Электрон самопроизвольно отрывается от атома в том случае, если Еj  40 эВ/ат.
40 эВ/ат.
Ионизационный потенциал также характеризует отрыв электрона от атома
UI B/ат.
Признаком неметалличности элементов является способность принимать электроны, т.е. окислительная способность.
|
|
|
| Cl0 | + е | 
| Cl- реакция восстановления |

| окислитель |
Количественной характеристикой неметаличности элементов является сродство к электрону – F эВ/ат.
Сродство к электрону – энергия, необходимая для отрыва принятого электрона.
Чем выше сродство к электрону, тем более сильным окислителем, т.е. неметаллом, является данный элемент.
Существует суммарная характеристика сродства к электрону и энергии ионизации. Это так называемая, относительная электроотрицательность элементов.

Относительная электроотрицательность показывает способность атомов притягивать к себе электроны при связывании с другими атомами.
Электроотрицательность можно выразить количественно и выстроить элементы в ряд по ее возрастанию. Наиболее часто используют ряд электроотрицательности элементов, предложенный американским химиком Л. Полингом.
| Элементы | Z | R,нм | EI, эв/ат | F, эв/ат | Электроотрицательность (ЭО) |
| Li | 0.55 | 5.39 | 1,0 | ||
| F | 0.064 | 17.4 | 3.61 | 4.0 | |
| Na | 0.189 | 5.14 | 0.9 | ||
| Cl | 0.099 | 12.07 | 3.45 | 3.0 | |
| Be | 0.113 | 9.32 | 1.5 | ||
| Mg | 0.160 | 7.65 | 1.2 |
Электроотрицательность измеряется в относительных величинах. Наиболее электроотрицательным из всех элементов является фтор (F) - его электроотрицательность в шкале Полинга принята равной 4,0. Остальные элементы по сравнению с фтором имеют меньшую электроотрицательность.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 389; Нарушение авторских прав?; Мы поможем в написании вашей работы!