
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Закон действия масс. Химическое равновесие
Скорость химической реакции зависит от многих факторов: t, природа веществ, катализаторы, давление и т.д. Но также зависит от концентрации веществ, которые реагируют.
Эта зависимость получила название закона действия масс, сформулированного Гульдбергом и Вааге:
Скорость химической реакции v прямо пропорциональная действующим массам, то есть концентрациям веществ, которые реагируют.
Скорость реакции не остается постоянной, а изменяется на протяжении времени по мере взаимодействия исходных веществ.
Рассмотрим обратимую реакцию
А + В ↔ С + D
Скорость прямой реакции v1 при постоянных t и Р прямо пропорциональная [A] и [B]:
v1 = k1[A][B];
где k1 - const v прямой реакции, зависит от природы веществ, t и P.
Соответственно
v2 = k2[C][D];
k2 - const v обратной реакции.
По мере взаимодействия А и В их концентрации уменьшаются, ведь уменьшается v1; наоборот [C] и [D] - увеличиваются, ведь v2 растет.
В конце концов наступает такой момент, когда v1 = v2. При постоянном равновесии скоростей наступает химическое равновесие - физическое содержание понятия равновесия. Другими словами, в единицу времени образуется столько продуктов C и D, сколько в это же время распадается с образованием А и В.
Химическое равновесие есть динамической процесс - реакция не прекращается, а продолжает идти с одинаковой скоростью в прямом и обратном направлении. В момент химического равновесия:
k1[A][B] = k2[C][D];
k1/k2 = K
Таким образом
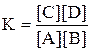
Отношение константы скорости прямой реакции к константе скорости обратной реакции есть величина постоянная и называется константой равновесия для данной реакции, при t = const.
Другими словами в состоянии равновесия отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ представляет собой константу равновесия данной реакции - есть величина постоянная - закон действия масс.
Всякое нарушение равновесия (при t и Р = const) путем изменения концентрации любого реагента немедленно приводит к новому состоянию равновесия.
Зная константы равновесия можно теоретически предсказать направление разнообразных химических реакций, которые стремятся к определенному состоянию равновесия.
Так, в нашем примере A + B ↔ C + D,
если К = 10-3, то соответственно закону действия масс, произведение равновесных концентраций продуктов в 1000 раз меньше, чем произведение концентраций исходных веществ. Равновесие сдвинуто влево, то есть указанная реакция протекает в основном в обратном направлении.
Для реакции типа a + b ↔ c + d, константа равновесия равна:
K = [C]c [D]d/ [A]a [B]b
|
|
Дата добавления: 2014-01-07; Просмотров: 8356; Нарушение авторских прав?; Мы поможем в написании вашей работы!