
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Теплоемкость идеальных газов
|
|
|
|
Нами уже была установлена связь между теплоемкостями идеального газа, или любого газа вообще, при постоянном давлении и при постоянном объеме (3.2.11). Таким образом, достаточно определить одну из теплоемкостей, а вторая определится из уравнения Майера. Проще найти выражения для теплоемкости при постоянном объеме.
Определим молярную теплоемкость идеального газа при постоянном объеме, взятого в количестве 1 моль (что не нарушит общности). Чтобы найти ее, необходимо задать вид зависимости внутренней энергии от температуры. Выше установлено, что для идеального газа, с точностью до постоянной, внутренняя энергия равна
 , (3.6.1)
, (3.6.1)
где 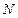 - число молекул газа.
- число молекул газа.
Согласно теореме о равнораспределении кинетической энергии по степеням свободы 
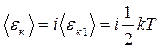 . (3.6.2)
. (3.6.2)
Здесь  - кинетическая энергия, приходящаяся на одну степень свободы.
- кинетическая энергия, приходящаяся на одну степень свободы.
Средняя кинетическая энергия молекул идеального газа определяется как (1.4.33)  . Однако этот вывод получен в предположении, что молекулы можно считать материальными точками, которые имеют три степени свободы. В этом случае элементарное приращение внутренней энергии одного моля идеального газа равно
. Однако этот вывод получен в предположении, что молекулы можно считать материальными точками, которые имеют три степени свободы. В этом случае элементарное приращение внутренней энергии одного моля идеального газа равно  , а молярная теплоемкость при постоянном объеме равна
, а молярная теплоемкость при постоянном объеме равна  . При обычных температурах экспериментальные значения молярной теплоемкости при постоянном объеме для гелия и аргона совпадают с теоретическими значениями
. При обычных температурах экспериментальные значения молярной теплоемкости при постоянном объеме для гелия и аргона совпадают с теоретическими значениями  . Однако для азота, кислорода, водорода, экспериментальные значения при обычных условиях больше предсказываемых теоретических значений примерно на величину универсальной газовой постоянной. Чтобы объяснить расхождение экспериментальных и теоретических результатов, пришлось отказаться от представления о молекулах как о материальных точках.
. Однако для азота, кислорода, водорода, экспериментальные значения при обычных условиях больше предсказываемых теоретических значений примерно на величину универсальной газовой постоянной. Чтобы объяснить расхождение экспериментальных и теоретических результатов, пришлось отказаться от представления о молекулах как о материальных точках.
|
|
|
Рассмотрим двухатомную молекулу. Пусть связь атомов в молекуле жесткая, то есть расстояние между атомами не изменяется. Такую систему можно считать абсолютно твердым телом, любое движение которого может быть представлено в виде суперпозиции поступательного движения центра масс и вращательного движения вокруг свободных осей (если не наложены связи). То есть у незакрепленного абсолютно твердого тела три поступательные и три вращательные степени свободы. Так как момент инерции двухатомной молекулы относительно ее оси симметрии пренебрежимо мал, то вращением относительно этой оси можно пренебречь и считать, что жесткая двухатомная молекула имеет три поступательные и две вращательные степени свободы. И молярная теплоемкость при постоянном объеме равна
 . (3.6.3)
. (3.6.3)
Итак, по классической теории выражения для молярных теплоемкостей идеального газа имеют вид
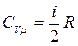 , (3.6.4)
, (3.6.4)
 (3.6.5)
(3.6.5)
и не зависят от температуры.
Если связь атомов в молекуле не жесткая, то возможно колебательное движение внутри молекул, то есть появляются колебательные степени свободы. Расчет числа колебательных степеней свободы можно выполнить следующим образом: если считать, что каждый атом привносит в молекулу 3 степени свободы, а в молекуле N атомов, то всего получается 3N степеней свободы. Из них 3 степени свободы определяют поступательное движение молекулы как целого, 3 (или 2 в случае двухатомной молекулы) - вращательное движение молекулы как целого, а остальные определяют колебательные степени свободы
 (3.6.6)
(3.6.6)
В привычных условиях теоретические значения теплоемкостей совпадают с экспериментальными. Однако для широкого диапазона температур была обнаружена зависимость теплоемкости от температуры. На рис. 3.6.1 приведена экспериментальная температурная зависимость теплоемкости водорода.

Рис. 3.6.1. Экспериментальная зависимость теплоемкости водорода от температуры
|
|
|
Классическая теория теплоемкости не может объяснить температурную зависимость теплоемкости газа. Можно только сказать, что двухатомный водород в некоторой области температур ведет себя как одноатомная молекула: вклад в теплоемкость дают только поступательные степени свободы, в следующем температурном интервале включаются вращательные степени свободы, и молекула водорода ведет себя как жесткая двухатомная молекула. При высоких температурах работают и поступательные, и вращательные, и колебательные степени свободы, молекула водорода «становится» упругой двухатомной молекулой. Но это всего лишь констатация факта, а не объяснение экспериментальной закономерности, которое может дать только квантовая теория теплоемкости.
На качественном уровне это может быть интерпретировано следующим образом: Согласна квантовой физике энергия, которой может обладать микрочастица квантована. Т.е она может принимать только ряд значений (говорят есть уровни энергии). Причем для поступательного, вращательного и колебательного движение значение и плотность этих уровней различная.
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 705; Нарушение авторских прав?; Мы поможем в написании вашей работы!