
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Реакції нуклеофільного заміщення та перегрупування
Вже в 20-х роках ряд реакцій почали пояснювати утворенням карбенієвих йонів (Г. Мейервейн, К.Інгольд, Ф.Уітмор). Ола на початку 60-х років минулого століття відкрив, що прості алкіл-катіони можуть існувати при низьких температурах в суперкислих середовищах (н-д, HSO3F + HF + SbF5). Останні на порядки кисліші, ніж навіть перхлоратна кислота. Часто реакції ведуть в рідких SO2 або SO2F2.
Реакції можна поділяти по типу реагенту: аніони (RO-, Cl-, N3-), нейтральні молекули (ROH, CO). Реакції дуже швидкі, надійно можна вимірювати швидкості тільки для стабільних карбокатіонів (Ar3C+).
1) Нуклеофільне заміщення з перегрупуванням. Реакція Меєрвейна – перетворення гідрохлориду камфену в ізоборнілхлорид:

(18)
В звичайних умовах тільки інколи реакції SN1 перебігають суворо за цим механізмом (спостерігається рацемізація). В більшості випадків рацемізація відбувається частково (участь SN2 механізму).
Деякі вчені вважають, що зростання виходу оберненого продукту зумовлено участю в реакції тісніших йонних пар. Тепер вважається, що є такі стадії дисоціації, які впливають на механізм заміщення (Уїнстейн).
RX ⇄ R+X- ⇄ R+ || X- ⇄ R+ + X-
Тісна йонна Розділена Сольватовані йони
пара йонна пара
В реакціях SN1 часто спостерігаються продукти елімінування та перегрупування разом з продуктами заміщення.
 (19)
(19)
Але деякі вчені стверджують, що ці зміни відбуваються за рахунок асоціації катіона і аніона. Про це говорять зміни в співвідношеннях продуктів заміщення і елімінування в різних розчинниках (від домінування заміщення до домінування елімінування). Сильна сольватація катіона в апротонних полярних розчинниках веде до його відділення (оголення) і це сприяє реакції елімінування.
Про утворення карбенієвих йонів можна судити з кінетичних даних, але кінетичні закономірності SN1 спостерігаються лише при наявності кінетично незалежних частинок, тобто при повній дисоціації на сольватовані йони. Додавання загального йона уповільнює SN1 процес. Перхлорат літію виявляє специфічний сольовий ефект, тобто прискорює реакцію, коли йони є слабоасоцийованими. Завдяки участі нуклеофільної групи Nu можливо утворення продукту збереження конфігурації і продукту перегрупування.
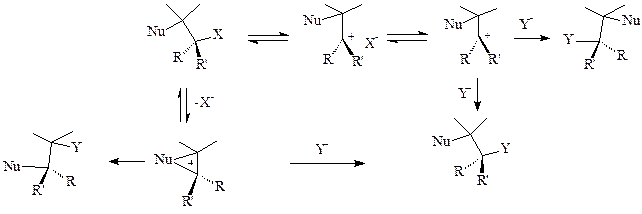
(20)
Використання кінетичного експерименту для доказу утворення карбенієвих йонів спотворюється участю розчинника у відриві відхідної групи та внутрішньому перетворенні йонної пари у вихідний реагент. В разі 1-адамантилтозилату та його 2-ізомеру маємо чистий SN1-механізм, в разі інших замісників спостерігається сильна участь сольватації розчинником відхідної групи (табл. 2).
Табл. 2.
| R в R-OTs | Відносна швидкість | ||
| CF3COOH | HCOOH | EtOH | |
| 2-Ad | |||
| exo -2-Norbornyl | |||
| endo -2-Norbornyl | 0,46 | 1,14 | |
| Cy | 0,3 | 1,5 | |
| Cp | |||
| Me | 0,02 | 3,5 | |
| Et | 0,04 | 1,4 | |
| t-Bu | 4.106 |
Сольволіз екзо -норборнілтозилату відбувається набагато швидше, ніж ендо -ізомеру. Утворюється рацемічний продукт, причому з міграцією тозилатної групи на 6-атом, що доводить утворення некласичного карбокатіона. ендо -Ізомер дає виключно продукт обернення конфігурації.

(21)
Для сольволізу трет -кумілхлориду в 90 % водному ацетоні розроблено шкала s+ для оцінки стабілізації замісниками карбенієвих йонів.
kX/kH = -4,54s+X
Вплив p-делокалізації заряду на швикість реакції можна прослідкувати на прикладі сольволізу аліл- і аралкілхлоридів в 80 % етанолі.
| R | Me2CH | CH2=CHCH2 | PhCH2 | PhCHMe | Ph2CH |
| 0,7 | 107 |
Часто константи швидкості вимірюються за допомогою техніки лазерного флеш-фотолізу (ЛФФ), в якому утворюються карбокатіони та радикали.
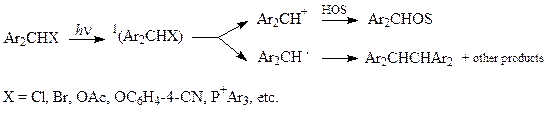 (22)
(22)
Катіони зникають при сольволізі швидко за експоненціальною залежністю. Прискорюється цей процес в присутності нуклеофілів. Азид-йони – індикатори на присутність карбокатіонів. Радикали зникають в присутності кисню.
Наведені в табл.3 дані показують, що найменш стабілізований серед показаних флуореніл-катіон забезпечує k сольволізу більше 4 . 1010 в воді.
Табл.3. Ефект розчинника на константи швидкості ks (s-1, 20 °С) сольволізу карбокатіонів
| Катіон | МеОН | EtOH | H2O | TFE | HFIP |
| An2CH+ | 8.6 . 106 | 5.5 . 106 | 1.0 . 105 | 1.4 . 101 | – |
| Ph2CH+ | 2.5 . 1010 | 1.4 . 1010 | 1.3 . 109 | 3.2 . 106 | 1 . 101 |
| 9-Флуореніл+ | >4 . 1010 | 8 . 106 | 2 . 104 |
Константи швидкості, помічені жирним шрифтом, виміряні методом наносекундного ЛФФ. Інші потребують пікосекундного ЛФФ. An – 4-метоксифеніл.
Дифенілметил-катіон має час життя в воді всього 1нс, бензил-, трет -бутил-катіони порядку пікосекунд. Константи швидкостей сольволізу корелюють з сумою s+ замісників при центральному атомі вуглецю, але для п -замісників в фенілі спостерігаються відхилення від лінійності. Специфічними слід вважати a-F3C та NC-заміщені бензильні карбокатіони, які, з одного боку, забезпечують на 7 порядків меншу швидкість утворення карбокатіонів ніж незаміщеного бензил-катіона, але, з другого боку, дають швидкості сольволізу зіставимі з бензил-катіоном. Зумовлено це тим, що a-заміщені бензильні катіони стабілізовані електроноакцепторними групами в хіноїдній формі, тобто резонансна взаємодія стабілізує перехідний стан реакції.
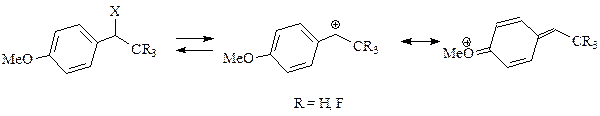
Хімічна стабілізація карбенієвих йонів (спонтанні перетворення)
Йони карбенію стабілізуються за рахунок елімінування протона, приєднання нуклеофілу, перегрупування або фрагментації з утворенням олефінів.
 (23)
(23)
При взаємодії карбокатіонів з n -електронними парами отщеплюється протон з b-положення від катіонного центру (23, 3-е рівняння). Прості алкіл-катіони дають координацію з нуклеофілом.
N-стабілізовані карбокатіони утворюються в першу чергу.
Коли є можливість утворення різних олефінів утворюються найзаміщеніші.
|
Дата добавления: 2014-01-07; Просмотров: 584; Нарушение авторских прав?; Мы поможем в написании вашей работы!