
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Энтропия. Второе и третье начала термодинамики
Любой химический процесс можно представить как совокупность двух явлений: во-первых, передачи энергии, во-вторых, изменения упорядоченности во взаимном расположении частиц. Термодинамическая функция, которая отвечает за изменение упорядоченности частиц получила название энтропии (S).
Энтропия - мера неупорядоченности системы. Энтропия пропорциональна логарифму термодинамической вероятности системы (W):
S = k ln W,
где k - постоянная Больцмана. Под термодинамической вероятностью понимают число способов, которым может быть реализовано данное состояние системы.
При переходе системы из более упорядоченного в менее упорядоченное состояние энтропия системы возрастает (D S >0), при переходе системы из менее упорядоченного в более упорядоченное состояние энтропия системы уменьшается (D S <0).
Второе начало термодинамики утверждает, что в изолированной системе самопроизвольно протекают только такие процессы, которые ведут к увеличению неупорядоченности системы, т.е. к росту энтропии. Основной смысл этого закона состоит в том, что в любой изолированной системе с течением времени происходит постоянное возрастание степени беспорядка, а, значит, и рост энтропии.
В закрытых термодинамических системах возможны химические реакции, которые протекают с уменьшением энтропии, т.е. D S Х.Р.<0. Однако это не противоречит второму началу термодинамики, поскольку полное изменение энтропии (D S ПОЛН.) в ходе любого процесса состоит из изменения энтропии в термодинамической системе (D S СИСТ.) и изменения энтропии в окружающей среде (D S ОКР.):
D S ПОЛН. = D S СИСТ. + D S ОКР.
Поэтому, если для какой-либо химической реакции D S Х.Р.<0, значит в ходе ее происходит значительное увеличение энтропии окружающей среды и суммарное изменение энтропии все равно будет больше 0.
Поскольку энтропия вещества является мерой беспорядка, то очевидно, что наименьшей энтропией будут обладать кристаллические вещества. Действительно, в кристаллах молекулы атомы или ионы расположены в узлах кристаллической решетки в строго определенном порядке.
Третье начало термодинамики (постулат Планка) утверждает, что энтропия идеального кристалла простого вещества при абсолютном нуле (0 К) равна нулю. Энтропия идеального кристалла сложного вещества при абсолютном нуле также принимается равной нулю.
газ
 S
S
жидкость
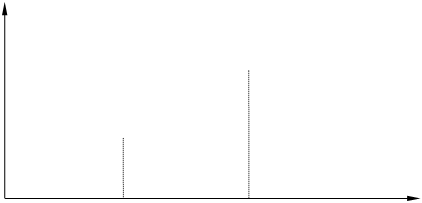
кристалл. в-во
0 T
TПЛ TКИП
Рис. 1.2. Изменение энтропии от температуры
Рассмотрим изменение энтропии от температуры (рис. 1.2). При 0 К согласно третьему началу термодинамики S =0. При повышении температуры молекулы, атомы или ионы, расположенные в узлах кристаллической решетки, начинают совершать колебания относительно положения равновесия. Причем, чем выше температура, тем больше интенсивность колебаний, и, следовательно, выше энтропия. При достижении некоторой критической температуры (температуры плавления) колебания становятся настолько сильными, что кристаллическая решетка разрушается, и вещество плавится. Это сопровождается скачкообразным увеличением энтропии. При переходе от кристаллического вещества к жидкости происходит разупорядочение структуры вещества, поэтому энтропия жидкостей больше энтропии кристаллических веществ. При дальнейшем нагревании происходит увеличение кинетической энергии частиц жидкости, что сопровождается постепенным увеличением энтропии. В какой-то момент времени, соответствующий температуре кипения, энергия всех частиц жидкости увеличивается настолько, что они становятся способными преодолеть силы взаимного притяжения. Жидкость закипает, т.е. переходит в газообразное состояние. Энтропия при этом снова скачкообразно увеличивается. В газах частицы находятся на значительном удалении друг от друга и лишь незначительно взаимодействуют между собой, пребывая в непрерывном хаотическом тепловом движении. По этой причине энтропия газов максимальна:
S (ТВ) < S (Ж) < S (Г).
Каждое вещество характеризуется стандартной энтропией S °298 - энтропией 1 моль вещества в его стандартном состоянии при 298.15 К и давлении 1 атмосфера. Значения стандартной энтропии определяются экспериментально или рассчитываются теоретически и заносятся в химические справочники. В данном методическом указании стандартные энтропии веществ находятся в табл.4.1 на с.23-24. Значения энтропии имеют размерность Дж/моль×К. Стандартные энтропии простых веществ не равны нулю!
Изменение энтропии в ходе химической реакции можно рассчитать как разность между суммой стандартных энтропий продуктов реакции и суммой стандартных энтропий исходных веществ по формуле:
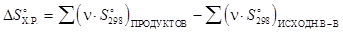 ,
,
где n - стехиометрические коэффициенты, с которыми исходные вещества и продукты реакции входят в термохимическое уравнение реакции.
|
|
Дата добавления: 2014-01-07; Просмотров: 1144; Нарушение авторских прав?; Мы поможем в написании вашей работы!