
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Скорость химической реакции
ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика - раздел физической химии, изучающий скорости и механизмы протекания химических реакций. Основной задачей химической кинетики является построение математической модели химической реакции (расчет скорости и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени) для выбора оптимальных условий ее осуществления.
Основным понятием химической кинетики является скорость химической реакции. Скорость химической реакции равна числу взаимодействий между частицами реагирующих веществ, приводящих к образованию продуктов реакции, в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (для гетерогенных реакций).
Гомогенной реакцией называется реакция, протекающая в однородной среде (в одной фазе), например, реакции в водных растворах или реакции между газообразными веществами. Гетерогенные реакции протекают на границе раздела фаз, например твердой и жидкой, твердой и газообразной.
Скорость химической реакции также показывает скорость, с которой образуются продукты, либо скорость, с которой расходуются реагенты при протекании химической реакции. Так как скорость реакции может изменяться с течением времени, то следует различать среднюю и мгновенную (истинную) скорости реакции.
Средняя скорость реакции v в интервале времени от t1 до t2 определяется соотношением:
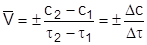 , ,
| (1) |
где с1 и с2 молярная концентрация любого участника реакции в моменты времени t1 и t2 соответственно. Знак «–» перед дробью относится к концентрации исходных веществ, поскольку с течением времени их концентрация уменьшается (вещества расходуются), а знак «+» - к концентрации продуктов реакции, так как с течением времени их концентрации повышаются (вещества образуются).
Истинная скорость реакции vt - скорость реакции в данный момент времени. Она определяется первой производной концентрации по времени:
| vt = dc / dt, | (2) |
и показывает изменение концентрации dc за бесконечно малый промежуток времени dt. В дальнейшем в данных методических указаниях под скоростью химической реакции мы будем понимать истинную скорость.
|
|
Дата добавления: 2014-01-07; Просмотров: 520; Нарушение авторских прав?; Мы поможем в написании вашей работы!