
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Особенности электролитической диссоциации комплексных соединений
|
|
|
|
Характерной особенностью комплексных соединений является их специфическая диссоциация. Первоначально при растворении комплексного соединения происходит его полная дисооциация на комплексный ион и противоионы внешней сферы. Т.е. комплексный ион ведет себя как индивидуальная частица. Этот процесс имеет необратимый характер и получил название первичной диссоциации:
K3[Fe(CN)6] ® 3K+ + [Fe(CN)6]3-
Лишь затем происходит частичная диссоциация комплексного иона на составляющие его лиганы и ион-комплексообразователь. Данный процесс получил название вторичной диссоциации. Протекает он в несколько стадий, на каждой из которых отщепляется только один лиганд. Все стадии имеют обратимый характер:
[Fe(CN)6]3- «[Fe(CN)5]2- + CN-
[Fe(CN)5]2- «[Fe(CN)4]- + CN-
[Fe(CN)4]- «[Fe(CN)3]0 + CN-
[Fe(CN)3]0 «[Fe(CN)2]+ + CN-
[Fe(CN)2]+ «[Fe(CN)]2+ + CN-
[Fe(CN)]2+ «Fe3+ + CN-
При этом отщепление каждого последующего лиганда становится все менее и менее вероятным. Для вторичной диссоциации комплексного иона можно записать суммарное уравнение:
[Fe(CN)6]3- «Fe3+ + 6CN-
Поскольку данный процесс обратимый можно согласно закону действующих масс можно записать выражение для его константы равновесия:
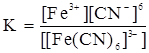
Данная константа получила название константы нестойкости комплексного иона (Кнест). Для многих ионов ее значение определено экспериментально и занесено в специальные справочники. Размерность константы определяется строением комплекса и пропорциональна размерности концентрации (моль/л). В справочных данных размерность Кнест не указывается.
Константа нестойкости является мерой стабильности комплексного иона в водных растворах: чем больше Кнест, тем менее устойчив комплексный ион, и наоборот, чем меньше Кнест, тем комплексный ион более устойчив.
|
|
|
Некоторые комплексные соединения обладают настолько высокими значениями константы нестойкости, что при их растворении в воде комплексный ион сразу же подвергается полной диссоциации. Т.е. происходит распад не только на внутреннюю и внешние сферы, а на все составляющие соединение ионы. Такие соединения получили название двойных солей, к ним относится, например, карналлит (KCl×MgCl2):
KCl×MgCl2 = K[MgCl3] = K+ + Mg2+ + 3Cl-
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1194; Нарушение авторских прав?; Мы поможем в написании вашей работы!