
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Законы электролиза (законы Фарадея). Выход по току
|
|
|
|
Разряжение анионов. Анодные процессы
Окислительные процессы, протекающие на аноде в водных растворах зависят от электролита и материала анода.
Аноды могут быть а) нерастворимыми или инертными (Pt, Au, Ir, графит или уголь и др.); б) растворимыми (активными) (Cu, Ag, Zn, Cd, Ni и т.д.). Инертные электроды при электролизе служат лишь передатчиками электронов. Активные электроды при электролизе окисляются и могут разрушаться и переходить в раствор в виде ионов. Анод тогда является активным (т.е. происходит его окиcление), когда его материал легче отдает электроны, чем анион в растворе (т.е. потенциал процесса Men+ + ne = Me самый низкий).
При электролизе на инертном аноде:
* бескислородных кислот и их солей (кроме HF и фторидов) – окисляются анионы;
* кислородсодержащих кислот и их солей с максимальной степенью окисления неметалла (SO42–, NO3–) – окисляются молекулы воды с выделением кислорода;
* кислородсодержащие кислоты и их соли, содержащие элемент (неметалл или металл) в промежуточной степени окисления (SO32–, NO2–) – окисляются анионы.
При электролизе с активным анодом происходит его разрушение (растворение).
Если в растворе содержится несколько анионов (возможно несколько анодных процессов), то предсказать последовательность их разряжения несколько сложнее, однако общая тенденция – в первую очередь разряжается тот анион (протекает тот электродный процесс), для которого характерно самое низкое значение электродного потенциала.
На аноде в первую очередь происходит окисление ионов или молекул, входящих в окислительно-восстановительную систему с наиболее отрицательным (наиболее низким) потенциалом (являющихся окисленной формой в окислительно-восстановительных системах с наиболее низким потенциалом).
|
|
|
Для количественных расчетов при электролизе применяют законы, выведенные Майклом Фарадеем. В 1834 г. Фарадей сформулировал открытий им закон: масса вещества, разложившегося на электродах во время электролиза, прямо пропорциональна количеству электричества, прошедшего через электролит. Этот закон стал вскоре использоваться для измерения силы тока.
Для практических расчетов важно следствие, получаемое из объединения двух законов Фарадея:
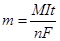 и соответственно для газообразных продуктов
и соответственно для газообразных продуктов 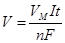 ,
,
где m – масса вещества (г), выделившегося при электролизе,
М – молярная масса вещества (г/моль),
I – сила тока (А),
t – продолжительность электролиза (с);
F – постоянная Фарадея (» 96500 Кл/моль)
V – объем газа (л), выделившегося при электролизе,
VМ – молярный объем (22.4 л/моль),
n – число электронов, участвующих в электродном процессе (в случае осаждения металла из раствора, n численно равно степени окисления металла, при выделении водорода n=2, кислорода n=4).
Показателем эффективности электролиза является выход по току, h (%), определяемый как отношение массы вещества, фактически полученной в данных условиях электролиза, к массе вещества, теоретически вычисленной на основании закона Фарадея.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1058; Нарушение авторских прав?; Мы поможем в написании вашей работы!