
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Средняя ионная активность и коэффициенты активности
|
|
|
|
Льюисом и Рэндаллом были введены некоторые математические поправки в соотношения, предложенные Аррениусом.
Для приведения в соответствие теории с практикой и сохранения многих удобных соотношений, ранее полученных на основании теории Аррениуса, было предложено использовать вместо концентраций активности. Тогда все термодинамические соотношения, записанные в форме уравнений для идеальных растворов, но содержащие не концентрации, а активности, строго согласуются с результатами экспериментальных измерений.
Г. Льюис и М. Рендалл предложили метод использования активностей вместо концентраций, что позволило формально учесть все многообразие взаимодействий в растворах без учета их физической природы.
В растворах электролитов одновременно присутствуют и катионы, и анионы растворенного вещества. Вводить в раствор ионы только одного сорта физически невозможно. Даже если бы такой процесс и был выполним, то он вызвал бы значительный рост энергии раствора за счет введенного электрического заряда.
Связь активностей отдельных ионов с активностью электролита в целом устанавливается, исходя из условия электронейтральности. Для этого вводятся понятия средней ионной активности и среднего ионного коэффициента активности.
Если молекула электролита диссоциирует на n+ катионов и n- анионов, то средняя ионная активность электролита a± равна:
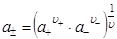 ,
,
где 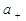 и
и 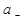 - активность катионов и анионов соответственно, n- общее число ионов (n= n+ + n-).
- активность катионов и анионов соответственно, n- общее число ионов (n= n+ + n-).
Аналогично записывается средний ионный коэффициент активности электролита 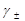 :, характеризующий отклонения реального раствора от идеального
:, характеризующий отклонения реального раствора от идеального
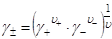 .
.
Активность можно представить как произведение концентрации на коэффициент активности. Существуют три шкалы выражения активностей и концентраций: моляльность  (моляльная, или практическая шкала), молярность с (молярная шкала) и молярная доля х (рациональная шкала).
(моляльная, или практическая шкала), молярность с (молярная шкала) и молярная доля х (рациональная шкала).
|
|
|
В термодинамике растворов электролитов обычно используется моляльная шкала концентраций.
Тогда
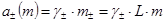 ,
,
где 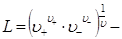 коэффициент, зависящий от валентного типа электролита.
коэффициент, зависящий от валентного типа электролита.
((Так, для бинарного 1,1-зарядного электролита ( ,
, 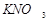 и др.)
и др.)
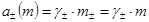
Для 1,2-зарядного электролита (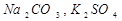 и др.) n+ = 2, n- = 1, n = 3 и
и др.) n+ = 2, n- = 1, n = 3 и
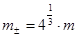 и
и 
В молярной шкале 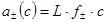 .))
.))
Между средними ионными коэффициентами активностей в моляльной 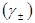 и молярной
и молярной 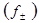 шкалах существует связь:
шкалах существует связь:
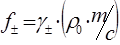 ,
,
где 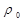 - плотность чистого растворителя. (конец самостоятельного рассмотрения)
- плотность чистого растворителя. (конец самостоятельного рассмотрения)
Г. Льюис и М. Рендалл ввели в употребление понятие ионной силы растворов 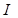 :
:
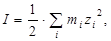
где 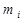 - моляльная концентрация
- моляльная концентрация 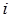 -го иона;
-го иона; 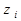 - заряд иона.
- заряд иона.
Они сформулировали эмпирическое правило постоянства ионной силы: в разбавленных растворах коэффициент активности сильного электролита одного и того же валентного типа одинаков для всех растворов с одной и той же ионной силой независимо от природы электролита.
Это правило выполняется при концентрациях не более 0,02 М.
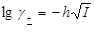
При более высоких значениях ионной силы усложняется характер межионного взаимодействия и возникают отклонения от этого правила.
4. Неравновесные явления в растворах электролитов. Законы Фарадея
Отвлечемся от логического повествования, чтобы перейти к материалу для проведения лабораторных работ.
Рассмотренные выше закономерности относились к условиям термодинамического равновесия, когда параметры систем не изменялись во времени. Нарушить электрохимическое равновесие можно наложением на ячейку электрического поля, которое вызывает направленное перемещение заряженных частиц (электрический ток), а также путем изменения концентрации растворенного вещества. Кроме того, на поверхности электродов и в растворе могут происходить химические превращения реагирующих веществ. Такое взаимное превращение электрической и химической форм энергии называется электролизом.
|
|
|
Закономерности электрохимических реакций лежат в основе разработки технологий важнейших процессов, таких как электролиз и гальванотехника, создание источников тока (гальванических элементов и аккумуляторов), защита от коррозии и электрохимические методы анализа. В электрохимии реакции восстановления принято называть катодными, окисления – анодными. Соотношение между количеством электричества 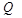 и массами прореагировавших веществ выражается законами Фарадея. (самостоятельно)
и массами прореагировавших веществ выражается законами Фарадея. (самостоятельно)
1-й закон. Масса 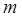 вещества, претерпевшего электрохимическое превращение, пропорциональна количеству пропущенного электричества
вещества, претерпевшего электрохимическое превращение, пропорциональна количеству пропущенного электричества 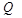 (Кл):
(Кл):
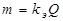 ,
,
где  - электрохимический эквивалент, равный массе прореагировавшего вещества при пропускании единицы количества электричества, г /Кл.
- электрохимический эквивалент, равный массе прореагировавшего вещества при пропускании единицы количества электричества, г /Кл.
2-й закон. При пропускании одного и того же количества электричества массы различных веществ, участвующих в электрохимических реакциях, пропорциональны их молярным массам эквивалентов (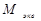 ):
):
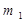 :
: 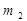 =
=  :
: 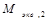 .
.
Отношение 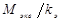 есть величина постоянная и равная постоянной Фарадея
есть величина постоянная и равная постоянной Фарадея 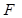 =96484 Кл/моль-экв. Таким образом, при пропускании
=96484 Кл/моль-экв. Таким образом, при пропускании 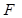 Кл электричества подвергается электрохимическому превращению 1 моль-экв любого вещества.
Кл электричества подвергается электрохимическому превращению 1 моль-экв любого вещества.
Оба закона Фарадея объединяются формулой
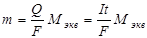 ,
,
где 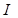 – сила тока, А и
– сила тока, А и 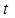 – время, с.
– время, с.
На практике, как правило, наблюдаются отклонения от этих законов, возникающие вследствие протекания побочных электрохимических процессов, химических реакций или смешанной электрической проводимости. Эффективность электрохимического процесса оценивается выходом по току
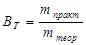 ,
,
где 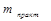 и
и 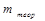 – масса практически полученного вещества и рассчитанного по закону Фарадея, соответственно. Немногие реакции, протекающие со 100% выходом по току, используются в кулонометрах – приборах, предназначенных для точного измерения количества электричества.
– масса практически полученного вещества и рассчитанного по закону Фарадея, соответственно. Немногие реакции, протекающие со 100% выходом по току, используются в кулонометрах – приборах, предназначенных для точного измерения количества электричества.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 11192; Нарушение авторских прав?; Мы поможем в написании вашей работы!