
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Лекция 12. Особенности концентрирования осаждением и соосаждением. Достоинства и недостатки
|
|
|
|
Подготовка ионообменников к работе
Перед использованием ионитов их разделяют по фракциям путем просеивания через сито с определенными отверстиями. Для аналитических целей применяют ионообменники с размером зерен 0,2 - 0,5 мм.
Товарные ионообменники обычно содержат примеси металлов Fe3+, Cu2+, Ca2+ и других (включения, образующиеся при синтезе вследствие коррозии аппаратуры), а также низкомолекулярные и растворимые продукты, которые перед началом аналитических работ следует удалить с помощью кислот и щелочей, а также органическими растворителями.
После очистки ионообменник переводят в требуемую ионную форму, применяя для этого растворы соответствующих реагентов и воду, которая не содержит примесей. В качестве реагентов используют раствор НС1 для перевода катионообменника в Н+ - форму, раствор щелочи для перевода анионообменника в ОН- - форму, раствор хлоридов или других растворимых солей для получения соответствующих солевых форм (Na+ - форма, Cl- - форма и т. д.). Ионообменник будет заряжен в ту или иную форму, если концентрации реагента на входе в колонку с ионообменником и в элюате равны.
Регенерацию ионообменников чаще всего проводят химическим методом, который заключается в обработке ионообменника реагентами, содержащими вытесняющий ион. Катионообменники регенерируют соляной кислотой, а также разбавленными растворами азотной и серной кислот: стадия поглощения
2RSO3H + CaCl2 о (RSO3)2Ca + 2HCl
стадия регенерации
(RSO3)2 Ca + 2HCl о 2RSO3H + CaCl2
Анионообменники можно регенерировать раствором гидроксида натрия. Скорость регенерации повышается в случае нагревания регенерирующего раствора.
Осаждение, как правило, применяют для разделения неорганических веществ. Осаждение микрокомпонентов органическими реагентами, и особенно их соосаждение, обеспечивают высокий коэффициент концентрирования. Эти методы используют в комбинации с такими методами определения, которые рассчитаны на получение аналитического сигнала от твердых образцов, например с атомно-эмиссионным и рентгенофлуоресцентным.
|
|
|
Разделение путем осаждения основано на различной растворимости соединений, преимущественно в водных растворах. Применяют органические и неорганические осадители. Если после осаждения равновесная концентрация ионов А в растворе равна [А] и, следовательно, в осадке СА - [А], то коэффициент распределения D равен
D=(CA-[A])/[A]
где СА - исходная концентрация ионов до осаждения.
В отсутствии конкурирующих реакций Са=[а] и молярная доля aA=[A]/CA=1, то в насыщенном растворе равновесная концентрация А рассчитывается по формуле
[A]=Ks/[L]
где [L] - равновесная концентрация осадителя; KS - реальное произведение растворимости.
Подставляя выражение (2) в уравнение (1) получаем:
D=(CA[L] - Ks)/Ks
Для повышения эффективности разделения реакцию осаждения комбинируют с кислотно-основными, окислительно-восстановительными реакциями и реакциями комплексообразования. В этих случаях для расчета D следует использовать условные произведения растворимости K's = C'AC'L:
D=(CACL `- Ks`)/ Ks`
Коэффициент разделения ионов А и В будет равен αA/B=DA/DB
Для количественного разделения ионов А и В необходимо, чтобы значение аА/B было большим и DaDb ~ 1.
Почти все селективные неорганические и органические реагенты для осаждения неорганических ионов пригодны для разделения. Можно выделить несколько групп осадков:
1) кислоты и гидратированные оксиды металлов (кремниевая, оловянная, вольфрамовые кислоты, гидраты оксидов железа (III), алюминия и т.д.);
2) малорастворимые соединения некоторых кислот (сульфаты, хлориды, карбонаты, сульфиды, фосфаты, оксалаты);
|
|
|
3) осадки с органическими реагентами (малорастворимые хелаты и ионные ассоциаты);
4) вещества, выделяемые в элементном состоянии (ртуть, теллур, селен, золото).
При концентрировании методом осаждения обычно выделяют матрицу, а не микрокомпонент. Важно получить осадок, свободный от микропримеси, для этого лучше использовать органические осадители. Концентрирование микрокомпонентов осаждением используют редко: содержание их столь мало, что твердая фаза не образуется. Для этих целей целесообразнее применять метод соосаждения микрокомпонентов.
Соосаждение можно рассматривать в двух аспектах: как нежелательный эффект, сопровождающий процесс осаждения и приводящий к загрязнению осадка, и как процесс направленного выделения микропримесей.
Соосаждение - явление загрязнения осадка примесями из раствора, которые в данных условиях осаждения сами по себе не могут образовывать малорастворимые соединения.
По технике эксперимента метод соосаждения имеет много общего с обычным осаждением. Обычно в раствор вводят реагент, способный к образованию малорастворимого соединения с одним из макрокомпонентов разделяемой смеси или специально введённым в раствор веществом, выступающим в роли носителя или коллектора микропримесей.
Коллектор - собиратель примеси. По другой схеме соосаждения в раствор вносят готовый тонко измельченный или в виде пасты осадок коллектора. При внесении готового осадка, если специально не создаются условия его перекристаллизации, происходит только поверхностная сорбция.
Типы коллекторов и их характеристика
В качестве коллекторов используются:
1) неорганические коллекторы;
2) органические коллекторы;
3) коллекторы смешанного типа.
В практике анализа в качестве неорганических коллекторов для группового соосаждения успешно применяются сульфиды и гидроксиды металлов, в частности, CdS, A1(OH)3, Fe(OH)3, Mg(OH)2. Для концентрирования урана из морской воды применяют гидроксид титана; для циркония и ниобия - гидроксид лантана. В качестве неорганических коллекторов при анализе природных вод используют также фосфаты и карбонаты металлов. Большим недостатком неорганических коллекторов является невысокая избирательность их действия. В ряде случаев отделение сконцентрированного элемента от носителя и других элементов достигается в результате использования экстракции, электролиза, проведения серии окислительно-восстановительных циклов или хроматографическим методом. Повысить избирательность действия коллекторов возможно за счет изменения условий соосаждения, например, варьированием рН, маскированием мешающих компонентов, а также при проведении дву- и многократных соосаждений с применением одного и того же или нескольких различных коллекторов.
|
|
|
Органические соосадители обладают большей избирательностью, чем неорганические коллекторы, и вследствие резкого преобладания химического механизма соосаждения в меньшей степени склонны соосаждать посторонние ионы из раствора. Еще одной причиной получения более чистых осадков является небольшая роль адсорбции неорганических ионов на поверхности органических коллекторов, либо отсутствие адсорбции. Из отфильтрованных осадков органический коллектор может быть удалён простым озолением; при этом, однако, не исключена возможность потери нелетучих следовых компонентов вследствие образования аэрозолей и захвата их движением воздуха. Потери можно уменьшить, если повышать температуру постепенно. Сожжение мокрым путем нагреванием с концентрированной серной и азотной кислотами, иногда в присутствии катализатора и окислителя, тоже значительно уменьшает потери примесей.
Использование органических коллекторов позволяет достичь чрезвычайно высоких коэффициентов концентрирования. В качестве примеров органических коллекторов можно назвать в-нафтол, антраниловую кислоту, оксихинолин, купферон, таннин, различные красители и т.д. Так, уран и кобальт соосаждаются в виде соответствующих а-нитрозо-в-нафтолатов; купферонат железа соосаждает ванадий, титан, олово и цирконий; диметилглиоксимат никеля соосаждает палладий и другие элементы;
8-оксихинолят меди извлекает кобальт, а 8-оксихинолят свинца используется для извлечения следов меди.
|
|
|
Органические коллекторы можно разделить на следующие группы: солевые, коллоидно-химические и индифферентные соосадители.
К группе солевых коллекторов относятся соединения, в химическом отношении являющиеся солями и имеющие в структуре катионную и анионную части. Поставщиками катионов для солевых соосадителей являются многие основные красители (трифенилметановые, родамины, аминоазосоединения и др.), фотосенсибилизаторы и фармацевтические препараты, соли тяжелых органических катионов, катионные поверхностно-активные вещества. В качестве поставщиков анионов используют различные продукты, являющиеся солями тяжелых органических анионов: сульфокислоты, кислотные красители, поверхностно-активные анионные соединения, любые реагенты с кислотными группами - SO3H или -COOH. Все они должны отвечать следующим требованиям: 1) образовывать с применяемыми катионами-партнерами малорастворимые соли; 2) при требуемых значениях рН должны существовать в растворах в виде анионов, а не в виде неионизированных кислот. В кислых растворах в ионизированном состоянии существуют только сильные кислоты и фенолы, содержащие несколько нитрогрупп. Сульфокислоты ионизированы в щелочных и среднекислых средах, а в сильнокислых растворах (>1-2 М) слабо ионизированы; 3) не должны содержать мешающих примесей. Соосаждаемые элементы могут входить в катионную или анионную часть солевого коллектора (таких комплексных ионов как [BiJ4], [Pu(NO3)6] ") или связываться с ней комплексно (с арсеназо или ализарином S), что в результате приводит к образованию малорастворимого соединения. Высокие коэффициенты концентрирования получают при использовании солевых коллекторов, образованных теми же реагентами, которые входят в состав соосаждаемого соединения. Например, элементы, связанные с арсеназо, лучше соосаждаются с осадком, образованным арсеназо с метиловым фиолетовым. Другим примером является соосаждение тетрароданоцинкат-аниона - [Zn(SCN)4] " роданидом метилового фиолетового - RSCN (R+ - катион метилового фиолетового) с образованием малорастворимого соединения - (R)2Zn(SCN)4. Элементы, не образующие роданидных анионов, не соосаждаются.
Для соосаждения коллоидных частиц и полиядерных катионов используют главным образом коллоидно-химические соосадители. Они представляют собой слаборастворимые продукты, образованные коллоидным веществом, (например, таннином) и основным красителем (таннатом основного красителя). Таннин - это смесь родственных растительных веществ, состоящих из эфиров глюкозы, образованных галловой, м-дигалловой или тригалловой кислотами. Таннин способен осаждать (коагулировать) многие коллоидные растворы и соли полиядерных ионов. В присутствии основных красителей осаждающее действие таннина усиливается, а при наличии танната основного красителя наблюдается процесс соосаждения. Например, таннин с метиловым фиолетовым извлекает ниобий из растворов при разбавлении 1: n ·1013. Аналогично таннину действуют и многие другие природные или синтетические высокополимерные материалы, используемые в виде коллоидных растворов, тонких суспензий или грубых взвесей, подобных мацерированной бумаге. Главным механизмом действия коллоидно-химических соосадителей является коллоидно-химическая коагуляция. Не исключается и соосаждение по солевому механизму. Однако избирательность соосаждения преимущественно определяется величиной полиядерных ионов и коллоидных частиц соосаждаемых элементов, а не собственно химическими свойствами элементов. Размер частиц, а следовательно, и способность соосаждаться зависят от условий приготовления растворов и получения соосаждаемой формы (рН, температура, время пребывания раствора в данных условиях).
С целью концентрирования следов элементов из их очень разбавленных растворов особое место в анализе занимает соосаждение с индифферентными соосадителями. Этот метод часто применяют в сочетании с другими методами выделения: осаждением и экстракцией. Индифферентные соосадители не содержат составных частей, вызывающих непосредственное осаждение элементов. Они увеличивают эффективность действия других соосадителей и, что особенно важно, затрудняют десорбцию соосажденных элементов при промывании осадков. Соосаждение с индифферентными соосадителями обычно рассматривают как экстракцию твердыми экстрагентами. Различают легкоплавкие (50-120 oС) и высокоплавкие (200-250 0С) индифферентные соосадители. Чем ниже температура плавления индифферентного соосадителя, тем он большее время будет находиться в виде жидких капелек и полнее соосадит примесь. В качестве индифферентных соосадителей используют малорастворимые в воде соединения - м-нитроанилин, в-нафтол, 2,4-динитроанилин, дифениламин, нафталин, тимолфталеин, м-динитробензол, п-дихлорбензол и другие соединения.
Наряду с названными выше довольно широко применяемыми группами органических коллекторов существуют единичные примеры соосадителей для специальных случаев. Это - тяжелые, быстротонущие и легковсплывающие соосадители; легколетучие органические коллекторы на основе камфары, п- дихлорбензола; бесцветные соосадители и пр. Бесцветные соосадители перспективны для фотометрического анализа. При этом в раствор вводят реагент, образующий с концентрируемым элементом окрашенное соединение, а затем органический соосадитель. Полученный осадок отфильтровывают, растворяют в подходящем растворителе и фотометрируют.
К коллекторам смешанного типа относятся соли органических кислот, оксалаты металлов и другие соединения.
Механизмы соосаждения. Соосаждение микропримесей из раствора представляет собой сложное явление и в зависимости от характеристик компонентов и условий эксперимента может протекать по различным механизмам: в результате адсорбции на поверхности коллектора или обмена ионов микрокомпонента с ионами осадка макрокомпонента, путем образования изоморфных (изоморфизм) или аномальных смешанных кристаллов (изидоморфизм), за счёт образования твёрдых растворов различных типов и т.д. В каждом конкретном случае соосаждения какой-то из этих процессов будет доминирующим.
Первой стадией соосаждения, как правило, является адсорбция ионов, приводящая к образованию химических соединений или твердых растворов.
Адсорбцией называется поглощение вещества поверхностью твердого тела (адсорбента). Существует несколько видов адсорбционных процессов, происходящих на поверхности осадков.
Молекулярная адсорбция - результат проявления поверхностных молекулярных сил Ван-дер-Ваальса. Аморфные осадки с высокоразвитой поверхностью в большей мере адсорбируют примеси из раствора. Такой вид соосаждения описывается уравнением Фрейндлиха.
Мономолекулярная адсорбция описывается адсорбционной изотермой Лэнгмюра, которая выражает зависимость количества поглощенного вещества от концентрации раствора при постоянной температуре. Математически эта зависимость описывается уравнением Лэнгмюра.
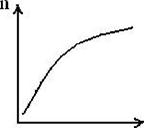
|
Рисунок - Изотерма адсорбции
По Лэнгмюру, на поверхности твердого тела имеются места с минимальной энергией, на которых могут адсорбироваться молекулы или ионы из раствора, образуя мономолекулярный слой. Число таких мест (пгю) определяет максимально возможное количество вещества, которое может быть адсорбировано. В области небольших концентраций, как видно из рисунка, изотерма линейна.
| (3.11) |
Адсорбция потенциалопределяющих ионов. Осадок адсорбирует на своей поверхности ионы, входящие в состав решетки, или другие потенциалопределяющие ионы, а эквивалентное количество противоионов, находящихся в растворе, удерживается у заряженной поверхности за счет электрического притяжения.
Адсорбция посредством ионного обмена. Следует различать два типа обменной адсорбции.
1 Обмен между ионами решетки и посторонними ионами
2 Обмен между противоионами.
В равных условиях преимущество в адсорбции имеют противоины с большим зарядом и концентрацией. В соответствии с правилом адсорбции Панета - Фаянса - Гана из двух одинаково заряженных ионов с одинаковой концентрацией осадок адсорбирует тот, который сильнее притягивается ионами решетки. Признаками более сильного межионного притяжения между сорбированными ионами решетки и противоионами являются: более низкая растворимость; меньшая степень диссоциации; более ковалентная связь; большая поляризуемость.
Число адсорбированных ионов возрастает также с увеличением поверхности осадка, т.е. мелкокристаллические и аморфные осадки адсорбируют больше ионов, чем крупнокристаллические. С увеличением температуры адсорбция уменьшается.
Правила адсорбции не применимы при образовании твердых растворов.
Твердыми растворами называют однородные кристаллические или аморфные фазы переменного состава, имеющие два или больше компонентов и сохраняющие однородность при изменении соотношений между ними.
При кристаллической фазе различают твердые растворы замещения, внедрения, вычитания и дополнения. В твердых растворах замещения атомы или ионы одного элемента становятся в кристаллическую структуру на места любых атомов или ионов другого элемента. В твердых растворах внедрения атомы одного элемента располагаются в промежутках между атомами другого. Твердые растворы вычитания представлены так называемой дефектной структурой, из-за наличия в ней пустот. В растворах дополнения часть молекул или противоионов переходит в узлы с одновременным внедрением в междоузлие для того, чтобы компенсировать дефицит заряда.
Частным случаем твердых растворов являются изоморфные смеси или смешанные кристаллы.
Изоморфизм - свойство ионов замещать друг друга в кристалле с образованием фаз переменного состава: смешанных кристаллов или твердых растворов.
В состав изоморфных соединений входят близкие по размерам ионы (разница в радиусах ионов не более 10 - 15 %) и растворитель при одинаковом типе кристаллической решетки. Изоморфными кристаллами являются, например, AgCl и AgBr; MgNH4PO4 и MgNH4AsO4; Zn[Hg(SCN)4] и Cu[Hg(SCN)4]; HgS и ZnS, MnS, CdS; KCl и KBr; BaSO4 и KMnO4. Изоморфно замещающие друг друга атомы и ионы могут иметь одинаковую (изовалентный изоморфизм) или разную (гетеровалентный изоморфизм) валентность, например, BaSO4 и KMnO4.
Сокращение межмолекулярных расстояний в результате деформации кристаллической структуры из-за различной формы молекул не должно превышать 0,4 - 0,5 А, искажение валентных углов должно быть также незначительным.
Изоморфное соосаждение подчиняется закону В.Г. Хлопина (3.12): если два сокристаллизующихся вещества (микро- и макрокомпоненты) являются истинно изоморфными, распределение микрокомпонента между твердой кристаллической фазой и раствором происходит в постоянном отношении к распределению макрокомпонента. Такая зависимость соблюдается при быстрой кристаллизации.
Образование химических соединений. Осаждаемые соединения вследствие образования с посторонними ионами труднорастворимых химических соединений захватывают примеси из раствора. Это имеет место при выделении марганца в виде H2MnO3 в присутствии ионов Zn2+ c образованием ZnMnO3; в результате ионы цинка увлекаются в осадок. Также при отделении хрома в виде CrO2- - ионов действием избытка щелочи в присутствии ионов Mg2+, Zn2+, Mn2+ и других образуются труднорастворимые хромиты указанных металлов и хром увлекается в осадок. Особым случаем является соосаждение элементов в коллоидном состоянии, например, при осаждении BaSO4 действием BaCl2 на разбавленную серную кислоту в присутствии гидролизованных солей железа и хрома. Захват сульфатом бария ионов Fe3+ и Cr3+ происходит вследствие взаимной коагуляции отрицательно заряженных коллоидных частиц (BaSO4)m-nSO42- положительно заряженными частицами гидроксидов железа и хрома ([Fe(OH)3]m-nFe3+, [Cr(OH)3]m-nCr3+), образованных вследствие гидролиза солей.
Образование химических соединений при соосаждении часто происходит в системе с компонентами, обладающими противоположными химическими cвойствами, например, кислотными (WO42-, MoO42-) и основными (Fe(OH)3), и пр. Соосажденные в результате химических реакций примеси не удаляются после промывания осадков, в отличие от поверхностной адсорбции ионов.
Окклюзия - вид соосаждения, при котором происходит механический или иной захват примесей или растворителя быстро образующимся растущим осадком макрокомпонента. Окклюзия обычно наблюдается при быстром выделении мелкокристаллических осадков на холоду. При введении микрокомпонента после образования твердой фазы соосаждение не происходит. Одной из основных причин окклюзии является неравновесная адсорбция, когда скорость роста частиц осадка превышает скорость установления адсорбционного равновесия.
Послеосаждение - наименее распространенный вид соосаждения, отличается от предыдущих тем, что переход примесей в осадок происходит не во время формирования осадка, а после его выделения. Кроме того, если соосаждение осуществляется из ненасыщенного раствора, то послеосаждение, как правило, происходит в пересыщенном растворе.
Заметное послеосаждение наблюдается при разделении металлов путем осаждения их в виде сульфидов. Так, при пропускании сероводорода в кислый раствор с рН около 0,5, содержащий ионы меди и цинка, сначала выделяется чистый осадок сульфида меди. Ионы цинка в этих условиях не образуют осадка сульфида вследствие низкой концентрации сульфид-ионов. Через некоторое время на поверхности осадка адсорбируются молекулы сероводорода в состоянии более сильной ионизации, чем обычно ему свойственно, благодаря притяжению ионов сульфида к соответствующим участкам решетки сульфидов металлов. В результате на поверхности осадка вследствие местного повышения концентрации сульфид-ионов достигается и превышается величина произведения растворимости сульфида цинка, возникают центры кристаллизации, что приводит к переходу ионов цинка в твердую фазу, т.е. послеосаждению цинка, несмотря на высокую кислотность раствора.
Лекция 13Испарение и родственные методы концентрирования.
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3504; Нарушение авторских прав?; Мы поможем в написании вашей работы!