
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие о теплоемкости веществ
|
|
|
|
Уравнение Кирхгофа
Влияние температуры на тепловой эффект химической реакции.
Зная стандартные теплоты образования (или сгорания) реагентов при
Т = 298 К, с помощью закона Гесса можно легко рассчитать стандартную теплоту химической реакции при данной температуре. Часто реальные процессы протекают при температуре, отличной от 298 К. Поэтому необходимо установить, как влияет температура на тепловой эффект химической реакции. Для этого необходимо ввести понятие теплоемкости вещества (системы).
Теплоемкостьсистемы (или тела) – характеризует количество теплоты, которое необходимо сообщить системе, чтобы повысить ее температуру на 1 градус (при отсутствии химической реакции, переходов вещества из одного агрегатного состояния в другое).
Теплоемкость может относиться к 1 моль системы – молярная теплоемкость С (измеряется в Дж/(моль ×К) или к единице массы системы – удельная теплоемкость С уд (измеряется в Дж/(кг ×К) или Дж/(г ×К))
Молярная и удельная теплоемкости связаны соотношением:
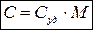 ,
,
где М – молярная масса.
Различают среднюю и истинную теплоемкости.
Средняя теплоемкость 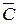 определяется отношением сообщенной системе теплоты к наблюдаемому при этом повышению температуры:
определяется отношением сообщенной системе теплоты к наблюдаемому при этом повышению температуры:
 .
.
Истинная теплоемкость С соответствует бесконечно малому изменению температуры:
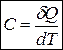 .
.
В зависимости от условий, при которых производится нагревание, различают теплоемкость при постоянном объеме СV (изохорную теплоемкость) и теплоемкость при постоянном давлении Cp (изобарную теплоемкость):
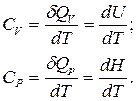 (3)
(3)
Для 1 моль идеального газа Cp и СV связаны соотношением:
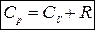 .
.
Изобарная и изохорная теплоемкости идеального газа отличаются на величину универсальной газовой постоянной R.
|
|
|
Для одноатомного идеального газа

Для двухатомного идеального газа при средних температурах

Изобарная и изохорная теплоемкости твердых веществ практически равны.
Теплоемкость твердых, жидких и газообразных тел зависит от температуры. Наиболее часто зависимость теплоемкости индивидуальных веществ от температуры выражают эмпирическим уравнением вида:
 , (4)
, (4)
где a, b, c, c ’ – эмпирические коэффициенты, вычисленные на основе экспериментальных данных.
Для органических веществ коэффициент c ’ = 0, для неорганических – c = 0. Для многих веществ коэффициенты a, b, c, c ’ приведены в справочниках.
Уравнение Кирхгофа
Уравнение Кирхгофа позволяет рассчитывать тепловые эффекты химических реакций при любой температуре.
Рассмотрим простейшую химическую реакцию – переход 1 моль вещества А в вещество В при температуре Т 2 и постоянном давлении р:
 .
.
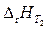 – тепловой эффект реакции.
– тепловой эффект реакции.
Эту реакцию можно провести в одну стадию или через ряд последовательных стадий, например:
1) нагреть вещество А до температуры Т 1 (тепловой эффект  , где
, где 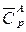 – средняя изобарная теплоемкость вещества А);
– средняя изобарная теплоемкость вещества А);
2) провести реакцию при температуре Т 1 (тепловой эффект  );
);
3) охладить продукт реакции – вещество В – до температуры Т 2 (тепловой эффект  , где
, где  – средняя изобарная теплоемкость вещества В).
– средняя изобарная теплоемкость вещества В).

Согласно закону Гесса
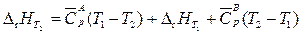 ,
,
 ,
,
где  – разность изобарных теплоемкостей продуктов реакции и исходных веществ.
– разность изобарных теплоемкостей продуктов реакции и исходных веществ.
Для химической реакции  рассчитывают по формуле:
рассчитывают по формуле:
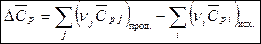 ,
,
где  – стехиометрические коэффициенты продуктов реакции и исходных веществ. Средние теплоемкости веществ приведены в справочной литературе.
– стехиометрические коэффициенты продуктов реакции и исходных веществ. Средние теплоемкости веществ приведены в справочной литературе.
Таким образом,
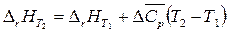 .
.
За температуру Т 1 удобно принять температуру 298 К, поскольку тепловой эффект реакции при 298 К можно легко рассчитать, используя первое или второе следствия из закона Гесса; Т 2 – температура реакции Т.
Тогда
 . (5)
. (5)
Уравнение (5) – уравнение Кирхгофа – позволяет рассчитать тепловой эффект химической реакции, протекающей при температуре Т (при условии, что в температурном интервале (298 – Т) теплоемкость мало зависит от температуры).
|
|
|
Анализ уравнения Кирхгофа.
– если Δ Ср > 0, то с повышением температуры тепловой эффект реакции будет возрастать;
– если Δ Ср < 0, с повышением температуры тепловой эффект реакции уменьшается;
– если Δ Ср = 0, то тепловой эффект реакции не зависит от температуры.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 469; Нарушение авторских прав?; Мы поможем в написании вашей работы!