
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Второй закон термодинамики
|
|
|
|
Второй закон термодинамики. Энтропия. Вычисление изменения энтропии для различных процессов. Постулат Планка. Энергия Гиббса и энергия Гельмгольца. Уравнение Гиббса-Гельмгольца. Самопроизвольное протекание химических реакций. Расчет изменения энергии Гиббса в химических реакциях. Химический потенциал. Активность и летучесть.
Первый закон термодинамики не дает критериев направления самопроизвольных и несамопроизвольных процессов и условий, при которых наступает состояние равновесия. Лишь с появлением в термодинамике понятия энтропия появляется строгий критерий направления самопроизвольных процессов. Термин энтропия, как и второй закон термодинамики, были введены Клаузиусом в середине ХIХ века. Карно показал, что в тепловых машинахтеплота, полученная от источника тепла, не может быть полностью переведена в механическую работу, а часть ее должна быть передана третьему телу – холодильнику. Это обобщение по существу выражает второй закон термодинамики и может рассматриваться как одна из формулировок второго закона термодинамики. Рассмотрим также некоторые другие формулировки второго закона:
Формулировка Клаузиуса (1850 г.). Не возможен самопроизвольный процесс передачи теплоты от холодного тела к горячему.
Формулировка Кельвина (Томсона) (1851 г .). Не возможно превратить теплоту какого-либо тела в работу, не производя никакого другого действия, кроме охлаждения этого тела;
Формулировка по Оствальду. Вечный двигатель второго рода невозможен (т.е. не существует машины, которая бы полностью превращала теплоту в работу).
Клаузиус, рассматривая обратимый циклический процесс, состоящий из двух изотерм и двух адиабат (см. учебники), разбил его на бесконечно малые участки, просуммировал (учитывая знаки dQ) все величины 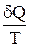 (элементарная приведенная теплота), и показал, что для обратимого процесса
(элементарная приведенная теплота), и показал, что для обратимого процесса
|
|
|
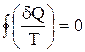 .
.
Если вспомнить свойства функции состояния, то для какой-то функции состояния Z интеграл 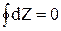 , поэтому величина
, поэтому величина 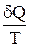 связана с какой-то функцией состояния. Эту функцию состояния назвали энтропией (S).
связана с какой-то функцией состояния. Эту функцию состояния назвали энтропией (S).
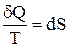 или
или 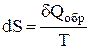 , (1)
, (1)
Выражение 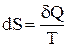 (равенство Клаузиуса) – это дифференциальная форма записи второго закона термодинамики для обратимых процессов. Для необратимых процессов, как показал Клаузиус, справедливо неравенство
(равенство Клаузиуса) – это дифференциальная форма записи второго закона термодинамики для обратимых процессов. Для необратимых процессов, как показал Клаузиус, справедливо неравенство
dS > 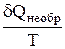 , (2)
, (2)
это дифференциальная форма записи второго закона термодинамики для необратимых процессов. В общем виде дифференциальная форма записи второго закона термодинамики для обратимых и необратимых процессов может быть представлена в виде:
dS 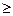
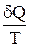 , (3)
, (3)
Единица измерения энтропии - такая же как и у соответствующей теплоемкости: молярной (мольной) –  , удельной –
, удельной – 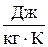
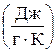 .
.
Энтропия – экстенсивная величина, т.е. пропорциональна массе системы.
Из дифференциальной формы записи второго закона термодинамики легко можно получить интегральную форму записи этого закона:
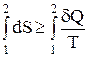 ;
; 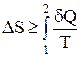 (4)
(4)
Первый и второй законы термодинамики можно объединить в так называемый объединенный первый и второй закон термодинамики, который для обратимых процессов можно записать следующим образом:
ТdS = dU + dA¢ + pdV. (5)
Если работа производится системой только против внешнего давления, то dA¢ = 0 и получаем:
ТdS = dU + pdV (6)
Отсюда вытекает, что:
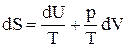 , (7)
, (7)
т.е. энтропия S является функцией внутренней энергии U и объема V: S = f(U,V).
В общем виде объединенный первый и второй закон термодинамики можно записать следующим образом:
ТdS 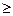 dU + dA¢ + pdV (8)
dU + dA¢ + pdV (8)
Если рассматривать только объемную работу, то получим:
TdS 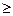 dU + pdV (9)
dU + pdV (9)
Второй закон термодинамики для изолированных систем.
Для изолированной системы dQ = 0, m = const, U = const, V = const. Для необратимых процессов, протекающих в такой системе, можно записать, что
|
|
|
dSнеобр. > 0
DSнеобр. > 0 т.е. S2 > S1 (11)
Выражения dS > 0 и DS > 0 можно рассматривать как математическую запись второго закона термодинамики, который для изолированной системы формулируется следующим образом:
в изолированной системе любой самопроизвольный процесс протекает только с увеличением энтропии, причем процесс закончится тогда, когда энтропия S достигнет своего максимального значения (когда наступит состояние равновесия).
При равновесии S2 = Smax = const и DS = 0. Схематически все сказанное можно изобразить на графике зависимости S от пути процесса:
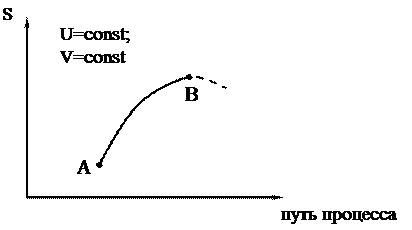 |
Путь процесса – это какая-либо величина, которая меняется при протекании процесса и поддается опытному определению.
Участок АВ – необратимый самопроизвольный процесс (DS > 0), энтропия возрастает; участок ВA – необратимый нeсамопроизвольный процесс (DS < 0), энтропия уменьшается; точка В – равновесное состояние (S=Smax).
Следует отметить, что если процесс протекает в неизолированной системе, то для оценки необратимости процесса необходимо иметь величину изменения энтропии системы и величину изменения энтропии окружающей среды.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3509; Нарушение авторских прав?; Мы поможем в написании вашей работы!