
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Постулат Планка. Третий закон термодинамики
|
|
|
|
Нернст показал, что энтропия конденсированных веществ при Т→ 0К- одинаковы, а Планк постулировал. что они не только одинаковы. но и равны 0. Оба утверждения называют третьим законом термодинамики.
Энтропия индивидуального (т.е. чистого) кристаллического вещества в виде идеального твердого тела при абсолютном нуле равна нулю.
Идеальным твердым телом называется твердое тело с идеальной кристаллической решеткой (не содержащей дефектов), в которой все узлы заняты атомами, молекулами или ионами.
Постулат Планка не противоречит соотношению Больцмана:
S = k lnW. (32)
Если предположить, что при Т = 0 К для идеального кристалла W = 1, то S = 0. Т.е. при Т = 0К в идеальном кристалле чистого вещества данное макросостояние может быть осуществлено только одним единственным способом (микросостоянием), когда каждый атом или молекула, или ион занимают свой узел кристаллической решетки. Беспорядок можно создать различными способами, а самое упорядоченное состояние – одним единственным способом.
При Т = 0 К S0T = 0, т.е. при 0 К мы имеем абсолютную точку отсчета энтропии, равную нулю, поэтому говорят об абсолютной энтропии.
Пусть нам надо рассчитать абсолютную энтропию,  , 1 моль вещества А при какой-то произвольной температуре Т, при которой это вещество является газом, и причем р = 1 атм. Составим схему превращений, которые происходят при этом с веществом:
, 1 моль вещества А при какой-то произвольной температуре Т, при которой это вещество является газом, и причем р = 1 атм. Составим схему превращений, которые происходят при этом с веществом:
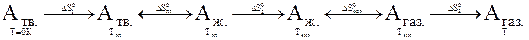
В начальном состоянии молярная энтропия вещества 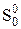 , а в конечном
, а в конечном  .
.
Как видно из схемы (с учетом того, что энтропия является функцией состояния):
DS0 = S0T –S00 = DS01 + DS0пл. + DS02 + DS0испар. + DS03 (33)
но S00 = 0, поэтому
S0Т = DS01 + DS0пл. + DS02 + DS0испар. + DS02. (34)
Или в сокращенном виде:
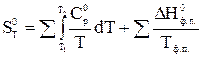 (35)
(35)
График зависимости абсолютной энтропии вещества от температуры Т будет иметь следующий вид:
|
|
|
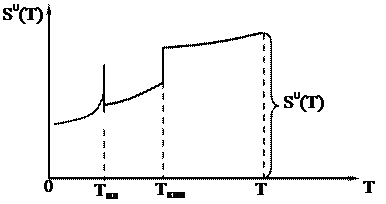 |
Изменение энтропии в химической реакции.
Рассмотрим изменение энтропии в химической реакции:
nАА + nВВ 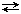 nDD + nЕЕ
nDD + nЕЕ
Изменение энтропии DrS в результате одного пробега реакции будет равно:
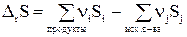 (29)
(29)
Если p=1атм, то получим
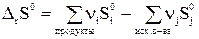 (30)
(30)
При p = 1 атм, Т = 298 К,
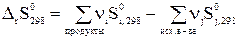 (31)
(31)
Единица измерения: [S0298] =  , [DrS0298] =
, [DrS0298] =  .
.
Пример 2.2. Определить изменение энтропии по величинам 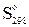 для реакции:
для реакции:
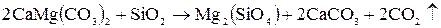 .
.
Решение. Расчет выглядит следующим образом (значения  веществ даны в справочниках):
веществ даны в справочниках):
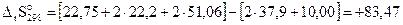 кал/(моль К).
кал/(моль К).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 721; Нарушение авторских прав?; Мы поможем в написании вашей работы!