
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Химический потенциал
|
|
|
|
Для системы, состоящей из одного вещества, справедливо:
 , (61)
, (61)
Любая экстенсивная функция состояния является функцией количества вещества в системе.
Поэтому, если система состоит из нескольких компонентов, то
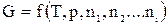 , (62)
, (62)
где ni – число молей i -го компонента. Продифференцируем (62) по ni
p, Т, nj≠i=const
 (63)
(63)
Величину  Гиббс назвал химическим потенциалом и обозначил μ i Его ещё называют парциальной мольной энергией Гиббса (парциальная термодинамическая функция Гиббса)
Гиббс назвал химическим потенциалом и обозначил μ i Его ещё называют парциальной мольной энергией Гиббса (парциальная термодинамическая функция Гиббса)
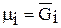
Можно дать следующее определение химического потенциала:
Это изменение энергии Гиббса однородной многокомпонентной системы при добавлении к ней 1 моля данного компонента при постоянных давлении, температуре и составе системы (т.е. добавление должно происходить при бесконечно больших количествах всех компонентов, чтобы состав системы не изменился).
Химический потенциал в отличие от, например, энергии Гиббса G, – интенсивная величина, т.е. он не зависит от массы системы, а зависит от природы системы и ее состава, температуры и давления. Вообще говоря, mi зависит от силы химического взаимодействия данного компонента с другими компонентами: чем это взаимодействие сильнее, тем меньше mi. Сила взаимодействия зависит от концентрации компонента, причем, чем меньше концентрация i-ого компонента, тем взаимодействие сильнее, и тем меньше mi. Вещество стремится переходить из состояния, где его m больше, в состояние, где его m меньше (т.е. туда, где сильнее взаимодействие данного компонента с другими компонентами).
Любая энергетическая характеристика есть произведение интенсивного фактора на экстенсивный. В нашем случае μi – интенсивный параметр, а ni – экстенсивный. Тогда:
|
|
|
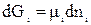 при T, p = const. (64)
при T, p = const. (64)
Введение некоторого количества dni молей i–го компонента при постоянном количестве других компонентов и постоянных Т и р будет увеличивать значение энергии Гиббса на величину  . Аналогичные изменения будут вызваны прибавлением других компонентов. Общее изменение энергии Гиббса системы при добалении в нее нескольких компонентов равно:
. Аналогичные изменения будут вызваны прибавлением других компонентов. Общее изменение энергии Гиббса системы при добалении в нее нескольких компонентов равно:
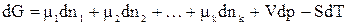 , (65)
, (65)
или, в общем случае,
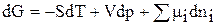 (66)
(66)
Это уравнение получило название фундаментального уравнения Гиббса.
Проинтегрируем соотношение (64) при постоянном составе системы (т.е. когда mi = const):
 ,
,
получим:
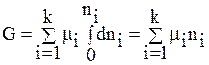 (67)
(67)
Соотношение (67) иногда называется уравнением Гиббса-Дюгема (чаще данное уравнение записывают таким образом:
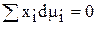 , где xi - молярная доля i-ого компонента.)
, где xi - молярная доля i-ого компонента.)
При р, Т = const для химической реакции верно:
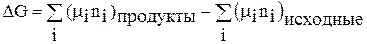 . (68)
. (68)
Расчёт химического потенциала идеального газа:
Если у нас есть один чистый компонент, то его химический потенциал m равен молярной энергии Гиббса  :
:
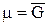 .
.  Но
Но
 (69)
(69)
(Здесь 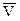 и
и 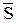 – молярный объем и молярная энтропия вещества), тогда получим:
– молярный объем и молярная энтропия вещества), тогда получим:
 (70)
(70)
Пусть идеальный газ находится при Т = const, тогда
dT = 0 и
dm = 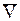 dp (71)
dp (71)
Проинтегрируем выражение (71) от р0 = 1 атм до любого р и, соответственно, от m0 до m; получим:
 ;
; 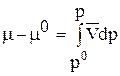 . (72)
. (72)
Но для идеального газа выполняется закон Менделеева–Клапейрона, который для 1 моль газа имеет вид:
р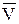 = RT, отсюда
= RT, отсюда 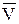 =
= 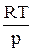 . (73)
. (73)
Тогда получим:
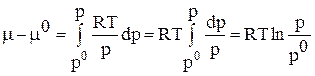 (74)
(74)
Если р0 = 1 а тм, то
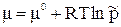 (75)
(75)
В уравнении (75) р – не само давление, а безразмерная величина, численно равная давлению, выраженному в атмосферах (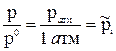 ).
).
m0 – стандартный химический потенциал, т.е. химический потенциал при стандартном давлении р0 = 1 атм;
Если же имеется смесь газов, то для любого i-ого компонента смеси.
mi = m0i + RT ln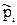 (76)
(76)
Здесь 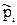 – безразмерная величина, численно равная парциальному давлению i-ого компонента смеси (т.е. той части от общего давления, которая приходится на i-ый компонент), выраженному в атмосферах (
– безразмерная величина, численно равная парциальному давлению i-ого компонента смеси (т.е. той части от общего давления, которая приходится на i-ый компонент), выраженному в атмосферах ( ).
).
Так как 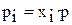 , где
, где 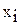 – мольная доля i–го газа в смеси, p – общее давление в системе, то
– мольная доля i–го газа в смеси, p – общее давление в системе, то
|
|
|
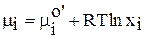 .
.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 384; Нарушение авторских прав?; Мы поможем в написании вашей работы!