
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Трехкомпонентные системы, концентрационный треугольник Гиббса. Метод термического анализа
|
|
|
|
Диаграммы плавкости двухкомпонентных систем.
6.1 Диаграммы плавкости двухкомпонентных систем.
Для двухкомпонентных гомогенных (однофазных) систем (Ф = 1) по правилу фаз Гиббса имеем:
f = K + 2 – Ф = 2 + 2 – 1 = 3, (1)
т. е. для описания состояния таких систем достаточно трёх переменных: давления, температуры и концентрации. Следовательно, для их графического изображения надо использовать объёмную (трёхмерную) диаграмму. Чтобы свести её к плоской, необходимо сократить число переменных. Поэтому при изучении конденсированных систем чаще всего строят диаграммы «точка кристаллизации (плавления) – состав» при постоянном давлении (обычно р = 1 атм.), благодаря чему диаграмма становится плоской.
Рассмотрим некоторые двойные системы различных типов.
1. Системы с неограниченной взаимной растворимостью компонентов в твердом и жидком состоянии (изоморфные смеси).
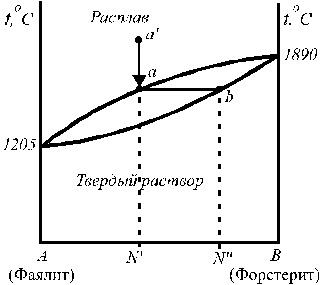 |
Рис. 1. Диаграмма состояния системы фаялит (Fe2SiO4) ‑ форстерит (Mg2SiO4)
На диаграмме, представленной на рис. 1, верхняя кривая (ликвидус) описывает зависимость температуры кристаллизации (плавления) от состава жидкого раствора (расплава), нижняя кривая (солидус) — зависимость температуры плавления от состава твердого раствора. Такие системы обычно образуют вещества, которые имеют одинаковый тип и близкие параметры кристаллической решетки (например, системы: медь – никель, золото – серебро) Состав выпадающих кристаллов не совпадает с составом равновесной с ними жидкости. В случае значительных отклонений от идеальности жидкого раствора на диаграмме состояния появляются экстремумы (например, для системы Сu – Au на диаграмме состояния есть минимум Т пл).
|
|
|
2. Плоская диаграмма плавкости (р = const) двухкомпонентных систем с неограниченной растворимостью компонентов в жидком состоянии и взаимной нерастворимостью в твердом состоянии (без образования химических соединений).
Такие диаграммы называют диаграммами эвтектического типа.
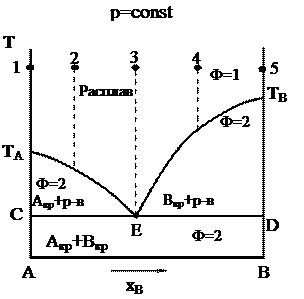 |
Особенностью диаграммы эвтектического типа является то, что при кристаллизации смеси состава (3) происходит одновременное выпадение кристаллов А и В.
Эвтектика – это не твердый раствор, а микрогетерогенная смесь кристаллов.
Жидкость, которая находится в равновесии с двумя кристаллическими фазами одновременно, называется эвтектической жидкостью, ее состав – эвтектическим составом, температура, при которой существует такое равновесие, называется температурой эвтектики (эвтектической температурой).
При кристаллизации смеси неэвтектического состава (точки 2 и 4) сначала выпадают кристаллы только того компонента, которого в данной смеси больше по сравнению с эвтектическим составом (в точках 2 и 4, это ‑ соответственно, А и В компоненты). При этом жидкость обогащается другим компонентом, а ее состав постепенно приближается к эвтектическому. Температура кристаллизации остающейся жидкости с изменением ее состава понижается. Когда температура достигнет эвтектической, образуется эвтектический расплав. Дальнейшая кристаллизация протекает при постоянной температуре (f = 0). При эвтектической температуре одновременно выпадают кристаллы обоих компонентов А и В. На всей линии CED состав расплава соответствует точке Е!
Линия ТАЕТВ называется линией ликвидуса, она показывает зависимость температуры начала кристаллизации расплава от состава расплава.
Линия CED называется линией солидуса, она показывает зависимость температуры конца кристаллизации расплава от его состава.
Выше линии ликвидуса система находится в жидком состоянии, а ниже линии солидуса – в твердом состоянии.
|
|
|
3. Диаграммы состояния бинарных систем с неограниченной растворимостью в жидком состоянии и ограниченной растворимостью в твердой фазе.
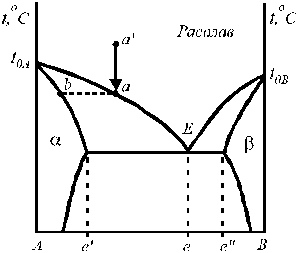 |
Рис. 2. Диаграмма состояния системы с ограниченной растворимостью в твердой фазе.
Для таких систем (например, альбит (NaAlSi3O8) — ортоклаз (КAlSi3O8)) состав насыщенных твердых растворов зависит от температуры (рис. 2). На диаграмме, представленной на рис. 2, поля α и β соответствуют областям существования гомогенных твёрдых растворов В в А ‑ (α) и А в В ‑ (β). При охлаждении расплава по пути а ¢ ® а в точке a расплав становится насыщенным относительно твёрдого раствора В в А (a), который и выделяется при дальнейшей потере теплоты. По мере понижения температуры расплав и равновесный с ним твёрдый раствор обогащаются компонентом В. В точке эвтектики Е расплав находится в равновесии с двумя твёрдыми растворами состава е ¢ и е ¢¢. Здесь в равновесии находится три фазы, система инвариантна (f = 2+1-3 = 0).
4. Системы, образующие устойчивые химические соединения, плавящиеся конгруэнтно.
На рисунке изображена типичная диаграмма плавкости системы, состоящей из компонентов А и В, образующих устойчивое химическое соединение АmBn, не способное образовывать твердый раствор с этими компонентами.
Точки плавления химических соединений, в которых состав твёрдой фазы одинаков с составом расплава, называются конгруэнтными (совпадающими).
 |
Эту диаграмму можно рассматривать как сочетание двух диаграмм плавкости систем с одной эвтектикой (т.е. системы A-AmBn и AmBn-B), рассмотренных нами ранее. Фигуративная точка О характеризует температуру плавления (кристаллизации) химического соединения АmBn.
В точке О – состав однокомпонентный; k = 1.
fО = 1 – 2 + 1 = 0 – система нонвариантная.
Если химическое соединение при температуре плавления частично диссоциирует по схеме: АmBn 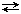 mА + nВ, то кривая Е1ОЕ2 становится более пологой в окрестности точки О.
mА + nВ, то кривая Е1ОЕ2 становится более пологой в окрестности точки О.
6. Диаграмма состояния бинарных систем с образованием химического соединения с инконгруэнтной точкой плавления.
Во многих случаях химическое соединение распадается до того, как будет достигнута его точка плавления.
|
|
|
Плавление соединения, в ходе которого состав кристаллической фазы не совпадает с составом расплава, называется инконгруэнтным.
На рисунке приведена диаграмма плавкости для системы, в которой оба компонента (А и В) образуют одно химическое соединение АmBn, плавящееся инконгруэнтно.
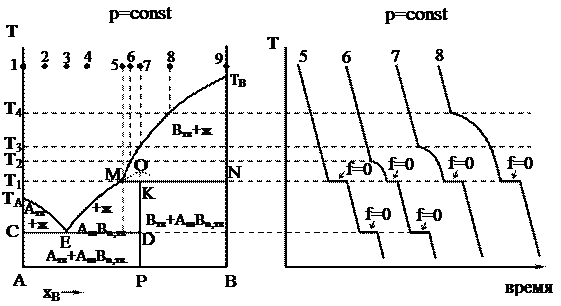 |
Так как неустойчивое химическое соединение АmBn полностью разлагается при Т1, которая ниже его температуры плавления, то максимум, отвечающий температуре плавления (точка О), не реализуется, а попадает в область, находящуюся под линией ликвидуса одного из компонентов (в данном случае – компонента В). Такой максимум называется скрытым. При Т1 химическое соединение начинает распадаться на жидкий расплав, изображенный на диаграмме точкой М, и кристаллы компонента В – точка N. Видно, что состав расплава не соответствует составу твердого соединения в точке Р.
Точка М называется переходной или перитектической точкой.
В процессе распада химического соединения расплав находится в равновесии с двумя твердыми фазами: кристаллами химического соединения АmBn и кристаллами компонента В, поэтому система – нонвариантная, так как f = 2 – 3 + 1 = 0.
Области диаграммы плавкости и равновесные фазы системы указаны на рисунке. Процессы охлаждения смесей составов 1–4, 9 не отличаются от рассмотренных ранее.
При охлаждении расплава состава, заданного фигуративной точкой 6, в интервале температур от Т2 до Т1 из расплава кристаллизуется компонент В (f = 2 - 2 + 1 = 1). При температуре Т1 из кристаллов компонента В и расплава образуется химическое соединение АmBn. Так как содержание компонента В в расплаве состава 6 меньше, чем в химическом соединении АmBn, то при Т1 ранее выпавшие кристаллы компонента В будут израсходованы, а до тех пор, пока не исчезнут последние кристаллы компонента В, система будет двухкомпонентной k = 2 и трехфазной Ф = 3, поэтому f = 2 - 3 + 1 = 0.
После исчезновения всех кристаллов компонента В система становится двухфазной (f = 2 – 2 + 1 = 1), следовательно, температура начнет падать (независимый параметр), и состав расплава при дальнейшей кристаллизации соединения АmBn будет изменяться по кривой МЕ (зависимый параметр). При эвтектической температуре ТЕ будет кристаллизоваться эвтектика, состоящая из кристаллов АmBn и чистого твердого компонента А (f = 0). Таким образом, в перитектической точке, как и в эвтектической, в равновесии находятся раствор и две твердые фазы. Однако процессы охлаждения этих трехфазных систем существенно различаются между собой: в эвтектической точке одновременно выпадают две твердые фазы, а в перитектической точке – одна твердая фаза выпадает, а другая – растворяется.
|
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1441; Нарушение авторских прав?; Мы поможем в написании вашей работы!