
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Понятие об электростатической теории сильных электролитов Дебая-Гюккеля. Правило ионной силы
|
|
|
|
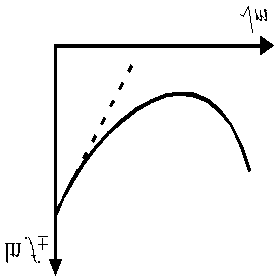 Средний ионный коэффициент активности зависит от концентрации раствора, эта зависимость показана на рис. 3. В области предельно разбавленных растворов электролитов эта зависимость имеет линейный характер в координатах
Средний ионный коэффициент активности зависит от концентрации раствора, эта зависимость показана на рис. 3. В области предельно разбавленных растворов электролитов эта зависимость имеет линейный характер в координатах  .
.
Рис. 3. Зависимость среднего коэффициента активности ионов
от концентрации электролита
Присутствие в растворе других солей изменяет коэффициент активности данной соли и тем сильнее, чем больше заряд добавляемых ионов. Суммарное действие всех ионов в растворе выражается через ионную силу раствора  ,
,
 , (24)
, (24)
где mi – концентрация i -ого иона; zi – заряд i -ого иона.
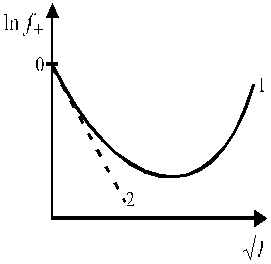 Зависимость среднего коэффициента активности ионов от ионной силы раствора имеет также аналогичный сложный характер и представлена на рис. 4.
Зависимость среднего коэффициента активности ионов от ионной силы раствора имеет также аналогичный сложный характер и представлена на рис. 4.
Рис. 4. Зависимость среднего коэффициента активности от ионной силы раствора.
Пример 2. Определить ионную силу раствора, содержащего на 1000 г воды 0,01 моль  и 0,1 моль
и 0,1 моль 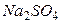 .
.
Решение. Ионная сила такого раствора равна


Пример 3. Определить ионную силу раствора 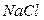 с моляльностью m = 0,5.
с моляльностью m = 0,5.
Решение. По уравнению (7.16) получаем
 .
.
Для растворов сильных электролитов выполняется правило ионной силы: в растворах с одинаковой ионной силой средние коэффициенты активности ионов равны.
Для теоретического расчета значений коэффициента активности f была предложена теория Дебая-Гюккеля. Она количественно учитывает ион-ионные взаимодействия и достаточно хорошо объясняет свойства разбавленных растворов сильных электролитов (a=1).
В основе теории Дебая-Гюккеля лежат следующие предположения:
1. электростатическое взаимодействие противоположно заряженных ионов приводит к тому, что вокруг положительных ионов вероятность нахождения отрицательных ионов будет больше, чем положительных.
|
|
|
2. между ионами имеет место кулоновское взаимодействие 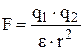
3. вокруг каждого иона формируется ионная атмосфера из противоположно заряженных ионов. (Сфера, в которой преобладает заряд, противоположный по знаку центральному иону среды, и называется ионной атмосферой).
Теория сильных электролитов приводит к следующему соотношению, связывающему средние коэффициенты активности ионов с ионной силой раствора в области сильно разбавленных электролитов:
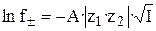 , (25)
, (25)
где A = f (ε, T) – константа, зависящая от диэлектрической проницаемости растворителя (e) и температуры (T).
Уравнение (25) применимо лишь при очень больших разведениях (I ≤ 0,01, рис. 4), почему и получило название предельного закона Дебая-Гюккеля.
Кривая 1 (рис. 4) описывает экспериментальную зависимость коэффициента активности от ионной силы раствора, кривая 2 описывает эту зависимость в соответствии с предельным законом Дебая-Гюккеля.
Для водных растворов бинарных электролитов при 25°С справедливо:
 . (26)
. (26)
ЛЕКЦИЯ 8
Удельная и эквивалентная электропроводность, их зависимость от концентрации для сильных и слабых электролитов. Подвижность ионов. Закон независимости движения ионов Кольрауша, предельная эквивалентная электропроводность. Аномальная подвижность ионов гидроксила и гидроксония. Экспериментальные приложения метода измерения электропроводности.
8.1 Удельная электропроводность растворов электролитов.
При наложении электрического поля на раствор электролита сольватированные ионы, находящиеся до этого в беспорядочном тепловом движении, начинают упорядоченное движение к противоположно заряженным электродам. С возрастанием скорости движения ионов возрастает сопротивление среды и через некоторое время скорость движения ионов становится постоянной.
|
|
|
Скорость движения ионов i -го вида  определяется градиентом потенциала электрического поля (напряженностью) E (В/см) и сопротивлением среды:
определяется градиентом потенциала электрического поля (напряженностью) E (В/см) и сопротивлением среды:
 ,
,
где U (В) – разность потенциалов между электродами,
l (см) – расстояние между ними,
ui (см2·В-1·с-1) – абсолютная скорость движения ионов в данных условиях (т. е. скорость движения ионов при Е = 1 В/см).
Мерой способности вещества проводить электрический ток при наложении внешнего электрического поля является электрическая проводимость (электропроводность) L.
На практике эта способность часто характеризуется обратной величиной — сопротивлением проводника.
Так, общее сопротивление проводника R (Ом) длиной l (см) и поперечным сечением S (см2) равно
 ,
,
где ρ – коэффициент пропорциональности, называемый удельным сопротивлением.
Удельное сопротивление – это сопротивление проводника длиной 1 см и сечением 1 см2,
Единица измерения ρ будет:
 . (3)
. (3)
Удельная электропроводность электролита æ — величина, обратная удельному сопротивлению:

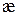

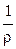
 [Ом-1·см-1]. (4)
[Ом-1·см-1]. (4)
Удельная электропроводность характеризует электропроводность слоя электролита толщиной в 1 см с площадью поперечного сечения в 1 см2.
Тогда
 æ
æ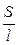 . (5)
. (5)
Удельная электропроводность раствора электролита определяется количеством ионов, переносящих электричество через сечение S=1 см2 и скоростью их миграции.
 |
Пусть между электродами, находящимися на расстоянии l (см), к которым приложена разность потенциалов U (В), находится раствор электролита (рис. 1). Для ионов i -го вида концентрация равна Ci (моль-экв/см3) и скорость миграции – υi (см/с).
Через поперечное сечение S раствора за 1 с мигрирует (Ci υi S) моль-эквивалентов ионов i -го вида, которые перенесут ( )
) 
количество электричества, где F – число Фарадея (96485 Кл/моль-экв). Количество электричества (Кл), перенесенное всеми ионами за 1 с (т. е. сила тока I) равно:
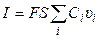 (6)
(6)
Или, с учетом (1),
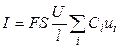 . (7)
. (7)
По закону Ома
I=U/R (8)
или  æ. (9)
æ. (9)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 396; Нарушение авторских прав?; Мы поможем в написании вашей работы!