
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Швидкість реакцій
|
|
|
|
Швидкість хімічних реакцій, включаючи любі реакції мінералоутворення рівна нулю в умовах рівноважної системи і досягає свого максимального значення при максимальному відхиленні від рівноваги.
Розглянему для прикладу реакцiю осадження доломiту iз розчину. Вона може бути виражена наступним чином
Ca2+ +Mg2+ + 2CO32- «CaMg(CO3)2
Швидкiсть реакцiї можна подати як швидкiсть iз якою продукується доломiт i
 |
швидкiсть iз якою зникає кожний iз вихiдних реагентiв
Швидкiсть реакцiї - це швидкiсть iз якою реагенти зникають, а продукти реакцiї зростають.
Для реакції A = С+D
Швидкість прямої реакції Âf[A]= 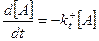 , де
, де 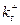 - константа швидкості прямої реакції, t- час, [ A ] – концентрація реагента A.
- константа швидкості прямої реакції, t- час, [ A ] – концентрація реагента A.
Швидкості зворотної реакції Âr[С]=d[С]/dt
Âr[D]=d[D]/dt
При рівновазі d[D]/dt = d[A]/dt
Âf[A]= Âr[C] = Âr[D]
Швидкість змінюється із зміною концентрацій реагентів
У рівнянні 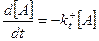 знак мінус свідчить про зменшення концентрації реагента A з часом, про розпад цього реагента. Варто відмітити, що в у цьому випадку швидкість розпаду A не залежить від концентрації C і D.
знак мінус свідчить про зменшення концентрації реагента A з часом, про розпад цього реагента. Варто відмітити, що в у цьому випадку швидкість розпаду A не залежить від концентрації C і D.
Це рівняння можна перетворити в 
В інтегральній формі воно може бути записано 
Інтегруючи в часі від 0 із початковою концентрацією [ A° ] до t із концентрацією [ A ] отримуємо

Експотенціюючи цей вираз отримаємо рівняння швидкості розпаду
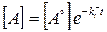 (9.1)
(9.1)
із константою швидкості k.
Якщо експонента є додатною, тобто якщо k від’ємне, то концентрація A зростає із часом і цей вираз є рівнянням швидкісті зростання. Зверніть увагу на експоненціальну зміну зміну концентрації із часом (ДИВ. рис. нижче)
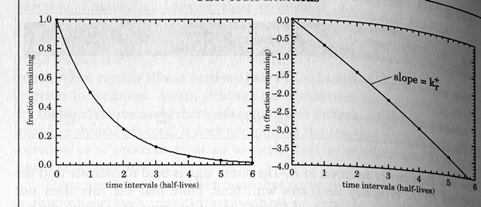
Поняття: час півжиття компонента t½ компонента A = час за який зникає половина компонента (при відсутності зворотної реакції))
|
|
|
Перетворюючи рівняння (9.1), якщо початкова концентрація дорівнює 1, то час півжиття компонента складає
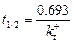
В геохімії нас звичайно цікавлять системи, до яких додається або забирається певна маса компоненту – відкриті системи. Для них існує поняття – час існування розчину
 де V – об’єм системи і Q – потік через систему
де V – об’єм системи і Q – потік через систему

Якщо компонент B продукується поки система перегружається
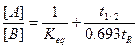
В цьому випадку система буде рівноважною за умови, якщо tR >> t1/2.
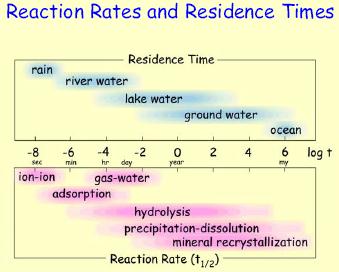
| Процеси | Час півжиття t½ |
| Іон-іонна взаємодія | 0.n – n.0 сек. |
| Взаємодія газ-вода | Години – дні |
| Адсорбція | Хвилини – години |
| Гідроліз | Години – роки |
| Розчинення – осадження мінералів | Дні – мільйони років |
| Перекристалізація мінералів | Роки – мільйони років |
Швидкiсть реакцiй мiнералоутворення зростає iз ростом температури за рахунок зниження енергiї активацiї реакцiй.
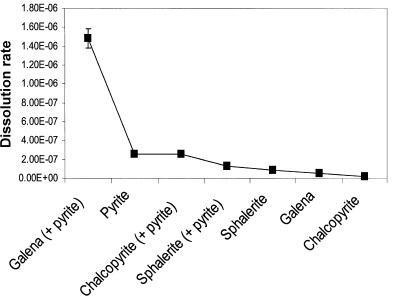
Рис. 6.3. Швидкість розчинення (mol m_2 s_1) одно і двох-фазових систем сульфідних мінералів
P. K. ABRAITIS 1,{, R. A. D. PATTRICK 1, G. H. KELSALL AND D. J. VAUGHAN Mineralogical Magazine, April 2004, Vol. 68(2), pp. 343–351)
Швидкiсть елементарних реакцiй не залежить вiд шляху. Якщо кiнцева реакцiя реалiзується через ряд елементарних реакцiй що протiкають iз рiзною швидкiстю, то в такому механiзмi iснує одна реакцiя, швидкiсть якої визначає швидкiсть протiкання кiнцевої реакцiї. Така елементарна реакцiя називається швидкiсть-визначальною.
В такому випадку можливi два варiанти:
Послiдовне протiкання елементарних реакцiй
A ------à B --------à C -------à P
В цьому випадку реакцiя iз найменшою швидкiстю контролює швидкiсть всього процесу
Протiкання на певному кроцi двох альтернативних (паралельних) реакцiй
----à C ----
¦ ¦
A ------à B - ---à P
¦ ¦
-----à D----
В цьому випадку швидкiсть процесу контролюється ланкою альтернативних реакцiй, а саме тою реакцiєю, що має бiльшу швидкiсть протiкання.
Зміна швидкості реакції при зростанні складності системи може бути показана на прикладі системи розчинення сульфідних мінералів в присутності або відсутності піриту (рис. 6.3)
|
|
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 261; Нарушение авторских прав?; Мы поможем в написании вашей работы!