
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гетеровалентний ізоморфізм
|
|
|
|
Ізовалентний ізоморфізм
Типи твердих розчинів
При формуванні твердих розчинів повинні виконуватися наступні вимоги:
1. Заселення кристалохімічної позиції різними елементами не повинно порушувати симетрію кристалу. Тобто заселення повинно бути хаотичним, невпорядкованим; неможливо передбачити позицію конкретного атома в просторовій сукупності точок даної позиції. Тому, маючи формулу діопсид-геденбергітового твердого розчину Ca(Mg0.7Fe0.25Mn0.05)[Si2O6], ми звичайно говоримо, що позиція M(1) цього моноклінного піроксену на 70% заселена магнієм, на 25% – Fe, на 5% – Mn.
2. Ізоморфізм можливий тільки у випадку збереження загальної електронейтральності кристалічної структури. Для твердих розчинів заміщення важливим є врахування валентності катіонів, що заселяють одну кристалохімічну позицію. Кристал як єдине ціле може існувати тільки як електронейтральне тіло: сумарний позитивний заряд катіонів завжди рівний по абсолютній величині сумарному негативному заряду аніонів. Хай кристал має хімічну формулу AnBmCk, де А і В - катіони з валентностями а і b відповідно, а С - аніон з валентністю с. Тоді умова електронейтральності цього кристалу виглядає таким чином: a n + b m = c k. Якщо, наприклад, n = m = 1, а = b = 2, одержимо формулу сполуки A2+B2+(C2-)2. Сумарний позитивний заряд в цьому випадку рівний +4, а сумарний негативний заряд -4. Варто пам’ятати, що чисельні значення величин зарядів рівні валентностям; в цьому сенсі не буде зроблено ніякої помилки, якщо замість поняття балансу (або компенсації) зарядів в іонних кристалах ми користуватимемося поняттям балансу (або компенсації) валентностей в ковалентних кристалах.
Тверді розчини заміщення – це самий простий тип твердого розчину, який повністю відповідає поняттю «ізоморфізм».
|
|
|
Якщо заміщення в межах однієї кристалохімічної позиції відбувається тільки між катіонами із однаковою валентністю, то такий ізоморфізм називається ізовалентним.
Ізовалентна схема ізоморфізму типова для піриту:
Fe2+ ó Nі2+óCo2+
та карбонатів
Fe2+ ó Mg2+óCa2+óMn2+
Прикладами ізовалентних заміщень є всі заміщення між атомами однієї і тієї ж групи Періодичної системи Менделєєва, наприклад K – Rb в польових шпатах і слюдах, Ca – Sr в арагоніту та апатиту, Tі – Sn в титаніту та перовськітів, Мо - W в ряді шеєліт Ca[WO4] – Ca[MoO4].
Візьмемо для прикладу епідот Ca2(Al,Fe3+)3O(OH)[SiO4][Si2O7]. Уявимо собі, що замість двовалентного іона Ca2+ в структуру епідоту ізоморфно входить тривалентний іон Ce3+. Якщо він повністю замістить Ca, тобто займе всі позиції в кристалі, зайняті раніше іонами Ca, а кількість (Al,Fe3+) при цьому не зміниться, то електронейтральність кристалу порушиться: сумарний позитивний заряд стане рівний 2 * 3 + 3 * 3 = +15, тоді як сумарний негативний заряд збережеться колишнім (-13). Кристал став би позитивно зарядженим, а така сполука існувати не може. Чи означає це, що заміщення двовалентного Са на тривалентний Ce взагалі неможливе? Ні, не означає, і існує декілька способів компромісного виходу з цієї ситуації. Перш за все це парне заміщення між іонами, що мають заряд однакового знаку, коли одночасно відбувається заміщення на більш високовалентний іон і іон з нижчою валентністю. Скажімо, при заміщенні Ca2+ на Ce3+ у структуру одночасно замість Fe3+ ізоморфно входить іон Fe2+. Електронейтральність кристалу в цьому випадку зберігається.
У випадку, якщо заміщення відбувається між іонами із різною валентністю, для досягнення електронейтральності відбувається гетеровалентний ізоморфізм, що може охоплювати одну, дві або більше кристалохімічних позицій і здійснюється таким чином, щоб сума зарядів іонів, що заміщуються, дорівнювала сумі зарядів іонів, що заміщують.
|
|
|
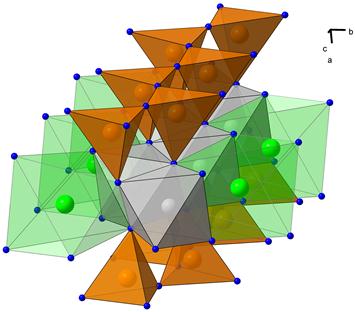
| Рис. 6.4. Кристалічна структура піроксену. Ланцюжки тетраедричних позицій, заселених Si, вершинами зв’язані із стрічками октаедричних позицій M1 і M2. Позиції M1 близькі до октаедричних, позиції M2 – неправильні шестивершинники. | ||||
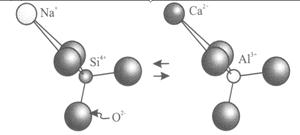
| Рис. 6.5. Схема гетеровалентного ізоморфізму Na++Sі4+ ó Ca2++Al3+ в плагіоклазах |
Гетеровалентний ізоморфізм може відбуватися за наступними схемами:
- Замішення двох іонів одного сорту однієї кристалохімічної позиції на два із різними зарядами.Приклад – 2Zn2+ ó Cu++Fe3+ у сфалериті; 2Fe3+ óFe2++Tі4+ в ряді гематит Fe2O3 -ільменіт FeTіO3.
- Замішення двох різних іонів із однаковим зарядом в двох різних позиціях на два із різними зарядами. Приклад – Ca2+(в M(2)) + Fe2+ (в M(1)) ó Na+(в M(2)) +Fe3+ (в M(1)) у піроксенах (рис. 6.4); Na++Sі4+ ó Ca2++Al3+ в плагіоклазах (рис. 6.5)
- Спряжене заміщення в катіонній та аніонній частині. Приклад – Zn2+S2+ ó Ga 3+ As3- в сфалериті.
- Заміщення двох пар різних атомів в нееквівалентних позиціях. Приклад –
Тверді розчини вакансій
Інший спосіб не порушити електронейтральність кристалу при гетеровалентному ізоморфізмі полягає в зміні числа катіонів (або аніонів) у формулі без зміни самої кристалічної структури. У цьому випадку частина точок певної кристалохімічної позиції залишається незайнятою, вакантною, Незайняті позиції називаються вакансіями і позначається значком c. Утворюється дефектний твердий розчин з дефіцитом катіонів (або, що рідше, аніонів): (A2+)1(B2+)1(C2-)2 à (A2+)0,5(D3+)1(C2-)2 і в структурі залишається 0,5 зайнятих А-позицій і 0,5 вакантних А-позицій.
Необхідно сказати, що в таких випадках, коли концентрація структурних вакансій досягає великої величини, кристалічна структура часто стає нестійкою і в ній з'являються впорядкування розподілу вакансій, тобто виникають зони сегрегації (скупчення) вакансій усередині гомогенного кристалу. Дуже добре вивчені в цьому відношенні мінерали групи піротину Fe1-xS. У цій формулі х > 0 означає частку вакантних позицій атомів Fe. Якщо частка х велика (більше або близько 10%), то виникає стехіометрична фаза типу Fe7S8, у структурі яких вакансії групуються в окремих плоских сітках, що протягуються через всю структуру. Граничне число вакансій, яке може акумулювати в собі структура, залишаючись стійкою, різне для різних структур.
|
|
|
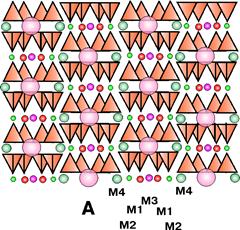 Твердий розчин вакансій характерний для рогової обманки. При заміщенні натрію кальцієм в позиції M(4) виникають вакансії в позиції A за схемою
Твердий розчин вакансій характерний для рогової обманки. При заміщенні натрію кальцієм в позиції M(4) виникають вакансії в позиції A за схемою
Na+ (A) + Na+ (M(4)) = ð(A) + Ca2+(M(4))
Рис. 6.6. Схема кристалічної структури амфіболу
Із утворенням вакансій може відбуватися входження індію в сфалерит. Твердий розчин ZnS – Іn2S3 утворюється за схемою – 3Zn2+ ó 2Іn3+ + c (вакансія).

| |
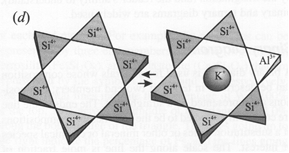
| Рис. 6.7. Формування твердого розчину вакансій у берилу Be3Al2[Sі6O18] o + Sі4+ ↔ Al3+ + (K+, Rb+, Cs+) або o + Sі4+ ↔ Be2+ + 2(K+, Rb+, Cs+) |
Тверді розчини із вакансіями характерні для вісмут-містячих галенітів Pb1-xBі2x/3S, борніту Cu5+xFeS4-xóCu5-xFeS4+x. Вони виникають при входженні алюмінію в октаедричні позиції флогопіту KMg3(OH)2[AlSі3O10] за схемою 3Mg2+ ó 2Al3++ c та при входженні скандію в структуру вольфраміту FeWO4 – 3Fe2+ ó 2Sc3+ + c. Тверді розчини із вакансіями виникають в перовськіті при заміщенні Na+ óCa2+ із утворенням вакансій в катіонних позиціях. Число таких вакансій може досягати 50% від даної структурної позиції. K, Rb, Cs, H2O входять в канали структури берилу
Тверді розчини заповнення простору виникають при гетеровалентному ізоморфізмі, коли для досягнення електронейтральності додатковий іон входить в порожнини каркасу поблизу кристалохімічної позиції, в якій відбувається заміщення. Таким чином трьохвалентні рідкісні землі в парі із додатковим іоном фтору входять в структуру флюориту замість кальцію Ca2+ à Y3+ + F-. Аналогічним чином відбувається заміщення Bі3+ à Cu+ + Pb2+ у вісмутину; Sі4+ ó Al3+ + [Lі+, Na+] в кварцу.
6.3. Кристалохімічні фактори, що контролюють ізоморфізм
v Розмір іонів, що заміщують один одного
Ø 15% критерій Ґольдшмідта із уточненнями О.С.Поваренних (правило Поваренних)
§ дуже досконалий ізоморфізм Dr = 0-5% при всіх температурах
§ досконалий Dr = 4-5 до 8-10 %, існують неперервні розчини при великих та середніх температурах
|
|
|
§ обмежений Dr = 8-10 до 14-16 % неперервні розчини тільки при високих температурах, із зниженням температури розчин втрачає гомогенність, відбувається розпад на фази, близькі за складом до кінцевих членів ряду.
§ недосконалий ізоморфізм Dr = 14-16 до 20-25%, спостерігається втрата гомогенності розчину навіть при високих температурах
§ дуже недосконалий ізоморфізм Dr > 25% – відсутність області гомогенності
Вказані межі залежать від валентності іону і зменшуються при рості валентності.
v Різниця електронегативності заміщуючих один одного атомів. Різниця значень електронегативностей не повинна перевищувати більше 0,4 по шкалі Л.Полінга. Відомо, що навіть при близькості розмірів (Å) іони Na+ (r = 0,95) і Cu+ (r = 0,96), K+ (r = 1,33) і Ag+ (r = 1,26), Ca2+ (r = 0,99) і Hg2+ (r = 1,10) не утворюють ізоморфних сумішей із-за великої відмінності електронегативностей (див. табл..), тобто, іншими словами, із-за різного характеру хімічного зв'язку із якими-небудь однаковими за розміром атомами. Приклад: Ca2+ - Cd2+ Dr = 5 %, Dc=0.6 – дуже недосконалий ізоморфізм; порівняємо із зразками досконалого ізоморфізму Na+ - K+ Dr = 36 %, Dc=0.1; Rb+ - K+ Dr = 12 %, Dc=0.0; Zn2+ - Cd 2+ Dr = 19 %, Dc=0.1.
v Правила полярності Гольдшмідта:
Ø Іон із меншим радіусом має переваги перед іоном з більшим радіусом при входженні в одну і ту ж кристалографічну позицію.
Ø Іон із більшим зарядом має переваги перед іоном з меншим зарядом при входженні в одну і ту ж кристалографічну позицію.
О.Є.Ферсман склав ряд пар елементів, в якому кожний верхній елемент легше заміщується нижнім, ніж навпаки:
| K | Ca | Tі | TR | Sc | Fe | Mg | ||||
| Ba | Pb | U | Th | Y | Nb | Ta | Th | Zr | Sc | Sc |
v Обмеження зумовлені вмістом елементів в середовищі. Відсутність в природі неперервних рядів, отриманих експериментально (наприклад, Nі в олівінах із гірських порід рідко перевищує 1 ваг.%, тоді як в лабораторії можна отримати неперервний ряд Mg2[SiO4]– Ni2[SiO4]). Інший приклад – вміст заліза в сфалериті залежить, при рівнозначних інших факторах від концентрації заліза в мінералотвірних розчинах. Коли в процесі кристалізації мінералу в середовищі не вистачає одного із компонентів, але наявний інший близький до нього за властивостями компонент, то він компенсує дефіцит основного компонента, входячи до мінералу як ізоморфна домішка. Такий ізоморфізм В.В.Щербина назвав компенсаційним. Компенсаційний ізоморфізм – входження Sr в апатит Ca2Ca3[PO4]3(F,Cl,OH) при низькій концентрації Ca в середовищі.
v Відмінності у гібридизації атомів, що заміщують один одного
Відображенням цього є фактична відсутність Zn в піротині. Справа тут у нездатності Zn створювати структурні конфігурації, притаманні перехідним металам. Дійсно, характерною рисою структури піротину є зближення атомів перехідного металу з незаповненою d-електронною оболонкою через грань сусідніх октаедрів (аналогічно структурному типу нікеліну) із відповідною хімічною і магнітною взаємодією між ними. На такі взаємодії атоми Zn із заповненими d -оболонками нездатні.
Ізовалентний ізоморфізм Zn ó Mn, Zn ó Cd є обмежений, так як стабільні сполуки MnS і CdS кристалізуються в гексагональній сингонії і є ізоструктурними вюртциту. Для змішування потрібно затратити енергію на перетворення сполуки, що розчиняється, в структурний тип мінерала-господаря. Виходом із ситуації є утворення нового мінералу із кратним співвідношенням двох катіонів. Як приклад цього можемо розглянути карбонати Ca і Mg. В цій системі існують три мінеральних фази –кальцит Ca[CO3], магнезит Mg[CO3] і доломіт CaMg[CO3]. Доломіт при цьому характеризується незначними відхиленнями від співвідношення Ca:Mg=1:1. Всі три мінерали є твердими розчинами із вузькою областю гомогенності.
Якщо детально розглянути ізоморфну пару Mg і Fe, різниця іонних радіусів яких складає 5%, що означає, що в залізомагнезіальних мінералах утворюються неперервні ряди твердих розчинів (наприклад, в олівінах Mg2SіO4-Fe2SіO4, піроксенах MgSіO3-FeSіO3, шпінелях MgFe2O4–FeFe2O4). Структури цих породоутворюючих мінералів залишаються стабільними при будь-яких кількісних співвідношеннях Mg: Fe. Інша дуже поширена в природі ізоморфна пара - Mg і Ca характеризуєтся різницею в іонних радіусах більше 30%. Ізоморфні заміщення Mg і Ca широко відомі - це мінерали группи клінопіроксенів (Ca, Mg)2[Sі2O6], карбонатів ряду кальцит Ca[CO3] – магнезит Mg[CO3], гранати, амфіболи та ін. Проте неперервних твердих розчинів Ca- і Mg-мінали не утворюють, існує межа розчинності Ca-міналу в магнезіальній структурі, так само як і Mg розчиняється в структурі кальцієвої сполуки тільки в обмеженій кількості.
Те ж явище обмеженої ізоморфної змішуваності є і при утворенні твердих розчинів в системах, які містять ізоморфні пари іонів лужних металів K+ и Na+. Найбільш відомі приклади - це NaCl (галіт, або поварена сіль), KCl (сильвін) і серія лужних польових шпатів - мінерали із класу алюмосилікатів K[AlSі3O8]–Na[AlSі3O8]. Іон K+ значно більший Na+, різниця іонних радіусів перевищує 30%, і повна (неперервна) ізоморфна змішуваність між цими елементами можлива лише при високих температурах. Зростанню ізоморфної змішуваності, або ж по іншому, збільшенню стабільності твердих розчинів сприяє ріст температури мінералоутворення. Збільшення амплітуди теплових коливань атомів у вузлах кристалічної ґратки призводить як до збільшення віддалі між атомами, так і полегшує зміну конфігурації координаційних поліедрів в ході пристосування їх під властивості атома–«чужака». У польових шпатів зростання ізоморфної змішуваності пояснюється тим, що, завдяки термічному розширенню, порожнини алюмосилікатного каркасу альбіту, які зайняті малими іонами Na+, стають співрозмірними із порожнинами для крупних іонів K+ в калієвому шпаті. Однак основна причина розширення області гомогенності твердих розчинів із ростом температури розкривається тільки при термодинамічному аналізі їх стабільності (див. нижче).
Втім, відомі приклади, коли близькі за розміром іони не заміщають один одного. Так, іонні радіуси Tі4+ і Sn4+ практично однакові і оксиди їх – рутил TіO2 і каситерит SnO2 – належать до одного структурного типу, тобто немає геометричних перешкод для взаємних заміщень між цими іонами. У таких випадках причиною незмішуваності, тобто неможливості утворення твердого розчину, є різний характер хімічного зв'язку в з'єднаннях Tі4+ і Sn4+, оскільки різниця їх електронегативностей складає 0,7. Якщо в першому випадку утворюються чисто іонні зв'язки, то в другому ковалентний характер зв'язку стає істотним. Подібні ж причини незмішуваності в кристалічних сполуках близьких за розміром атомів Ca і Hg, Sr і Pb, K і Ag, Na і Cu.
Ряди ізоморфізму Вернадського
| КЧ | Ряд ізоморфного заміщення іонів |
| Al3+, Fe3+, Cr3+, Mn3+, Ті4+, V4+ | |
| Mg2+, Fe2+, Mn2+, Ca2+ | |
| Si4+, AI3+,Ti4+, B4+, P4+ | |
| 6-8 | Ca2+, Na+, Ba2+, Sr2*, Pb2+, Ce (REE), Th, U |
| NH4+, K+, Na+, Cs+, Rb+, Li+ | |
| P4+, As4+, V4+ | |
| Sb3+, As3+ Bi3+ | |
| Zn2+, Fe2+, Mn2+, Hg2+ Cd2+, Cu2+, Ni2+, Co2+ | |
| 2-3 | Ag+, Cu+ |
| Fe2+, Co2+, Ni2+ | |
| Ti4+, Nb5+, Ta5+ | |
| W4+, Mo4+ | |
| Br-, J-, Сl- | |
| О2-, F-, OH-, Сl- | |
| S2-, Se2-, Те2-, As3- | |
| Pt, Fe, Pd, Ir, Rh | |
| Os, Ru, Rh, Ir | |
| Au, Ag, Cu, Pd, Hg |
Кожний твердий розчин має своє поле стабільності – інтервал температури і тиску, в межах якого він існує. У разі виходу за межі поля стабільності відбувається розпад твердих розчинів.
Область існування однієї фази твердого розчину називається областю гомогенності, а якщо одночасно існують два типи твердих розчинів, то вони розділені областю розриву розчинності (див. рис. 5.8, на якій показані розриви розчинності в системі карбонатів).
Якщо тверді розчини характеризуються широкими коливаннями складу без розпаду, то говорять, що вони мають широку область гомогенності, мінерали ж, що здатні тільки в незначній мірі розчиняти інші мають вузьку область гомогенності.
Якщо ми маємо два мінерали, що утворюють між собою тверді розчини в будь-якій пропорції, тоді такі мінерали утворюють між собою неперервні ряди твердих розчинів (досконалий ізоморфізм. Якщо два мінерали утворюють розчини тільки в для певних вузьких інтервалів взаємних концентрацій, розділених одним або декількома інтервалами розривів розчинності, то варто говорити про перервні ряди твердих розчинів (недосконалий ізоморфізм).
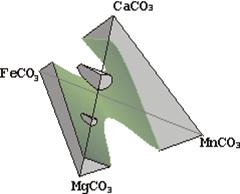
| Рис. 5.8. Тетраедрична діаграма хімічного складу тригональних карбонатів Mg, Mn, Fe, Ca. На лінії Ca – Mg видно поля доломіту CaMg[CO3]2 і гунтиту CaMg3[CO3]4 Видно розрив розчинності між кальцитом та магнезитом, магнезитом та родохрозитом, кальцитом та сидеритом. Неперервний ряд твердих розчинів між магнезитом та сидеритом, сидеритом та родохрозитом, кальцитом та родохрозитом |
ЯК РОЗМІЩУЮТЬСЯ ІЗОМОРФНІ АТОМИ В КРИСТАЛІЧНІЙ СТРУКТУРІ?
Якщо два атоми (катіони) A і B входять в одну кристалохімічну позицію, то у них встановлюються зв’язки із одним і тим же аніонним оточенням – атомом C. Поряд із цим не існує двох поєднань різних катіонів із одним аніоном із однаковою міжатомною віддаллю. Яким чином можна розмістити атоми із різною віддаллю із оточенням в одній структурі, зберігши її симетрію? Згідно правила Вегарда, параметри елементарної комірки твердого розчину описуються
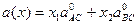
де x1 та x2 – мольні частки і 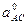 та
та 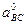 – параметри комірки чистих компонентів суміші
– параметри комірки чистих компонентів суміші 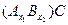 . Найбільш простим способом розв’язання цього конфлікту є модель «чергування зв’язків», коли домішкові атоми повторюються в структурі із певним періодом.
. Найбільш простим способом розв’язання цього конфлікту є модель «чергування зв’язків», коли домішкові атоми повторюються в структурі із певним періодом.
В такій структурі всі індивідуальні зв’язки дорівнюють їх середнім значенням
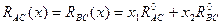
При розміщенні в деякій кристалічній структурі (рис. 6.5а) ізоморфних атомів двох сортів, А і В, можливі різні ситуації. Якщо атом даного сорту (А) прагне мати в своєму найближчому оточенні атоми іншого сорту (В), спостерігається впорядкований розподіл ізоморфних атомів (рис. 6.5б). Розміщення, при якому кожен атом даного сорту (А) має в своєму найближчому оточенні атоми обох сортів (А і В) (рис. 6.5, в), називається невпорядкованим. Між цими крайніми випадками існують проміжні - ізоморфні атоми розміщуються з різним ступенем впорядкованості залежно від температури, тиску, хімічного складу твердого розчину. Загальним правилом є збільшення ступеня невпорядкованості із підвищенням температури, оскільки безлад викликає зростання конфігураційної ентропії, роль якої підвищується при високих температурах (- TSk). Сегрегація атомів одного сорту кінець кінцем приводить до розпаду твердого розчину і утворення двофазної системи (рис. 6.5, г).
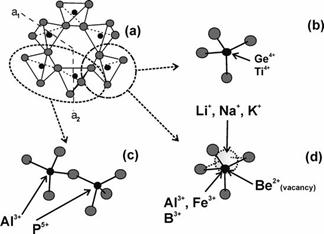 Рис. 6.9. Схеми ізоморфного входження елементів-домішок у структуру кварцу.
Рис. 6.9. Схеми ізоморфного входження елементів-домішок у структуру кварцу.
a. Кристалічна структура a–кварцу.
b. Конфігурація чотирьохвалентних іонів (Ge, Tі), що заміщують Sі.
c. Схема заміщення двох сусідніх позицій Sі4+ парою P5+ + Al3+.
d. Входження тривалентних катіонів (Al, Fe, B) в позицію Sі4+ викликає дисбаланс заряду 1+. Баланс заряду досягається входженням одновалентних катіонів (Lі, Na, K) в канали, що проходять паралельно осі c або коли дефекти структури є достатніми для входження в них великого катіону.
(Larsen et al, 2004)
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1444; Нарушение авторских прав?; Мы поможем в написании вашей работы!