
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Сила кислот і вільна енергія
|
|
|
|
 
| Рис. 2. Розміщення пар кислота-основа відповідно до вільної енергії відриву протону від кислоти. В центрі показані кислоти і пов’язані із ними основи, розміщені у відповідності із вільною енергією переміщення одного протону від кислоти до H2O. Нульові значення вільної енергії та pH приписані реакції переміщення протону від однієї молекули води до іншої. H3O+ + H2O = H2O + H3O+ Вищі вільні енергії характеризують сильні кислоти (HNO3, HCl, H2SO4), які в природних умовах фактично є повністю дисоційовані і безпосередньо в геохімічних процесах участі не приймають. Винятком можуть бути тільки екстремальні умови окиснення сульфідних руд чи конденсації вулканічних газів у фумаролах та сольфатарах. В цих умовах можуть виникати від’ємні значення pH. Так само, не реалізуються в природі реакції дисоціації сильних основ. pH середовища природних процесів визначається слабкими кислотами та основами, що обведені на схемі рамкою. |
Низькі значення pH у природних водних системах створюються дисоціацією гідросульфат-іону HSO4-, органічних кислот (мурашиної HCOOH та оцтової CH3COOH) і гідратизованих іонів Fe3+ і Al3+ (Fe(H2O)63+ і Al(H2O)63+), дисоціація яких відбувається за схемою
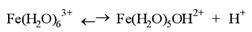
а також вугільної кислоти H2CO3.
Високі значення pH задаються гідрокарбонат-іоном HCO3-, амонієм NH4+, гідро фосфат-іоном HPO42-, в меншій мірі ціанистою кислотою HCN.
Зміна pH розчину супроводжується зміною концентрацій всіх сполук, що приймають участь у дисоціації кислот і основ. Це можна зобразити на графіку pH–pC (pC = -log(a C) ~ -log(m C).
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 276; Нарушение авторских прав?; Мы поможем в написании вашей работы!