
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
N Окисно-відновні реакції є найбільш енергетичними (із найбільшою ентальпією) в геохімії
|
|
|
|
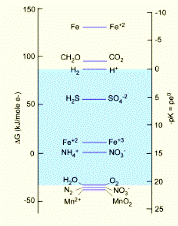
Нижче наводяться деякі важливі редокс-реакції, їх константи рівноваг та вільні енергії.
Таблиця 8.1.

| 
|
По аналогії із кислотно-основними взаємодіями, із схеми ми бачимо, що тільки частина реакцій попадає в поле стабільності води, обмежене реакціями
H2 = 2H+ + 2e-
0,5 H2O = 0,5O2 + 2e- + 2H+
Такі реакції, як перетворення N2 → NO3- та Mn2+ → Mn4+ є ендотермічними і потребують каталізаторів, або ж відбуваються не прямо, а через проміжні реакції. З іншої сторони, окиснення ацетатів (CH2O→CO2) і заліза (Fe0 → Fe2+) відбуваються із настільки великим виділенням енергії, що відповідні початкові сполуки є повністю нестабільними в природних умовах, в першу чергу в зоні гіпергенезу.
Вільна енергія G пов’язана із електричною напругою Δ E рівнянням
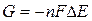
де n – кількість електронів, що приймають участь у пів-реакції, F – число Фарадея, рівне 9.64846 ·104 кулон/моль
Параметрами окисно-відновних реакцій є величина Eh для низькотемпературних водних систем і фугітивність кисню (fO2) для високотемпературних водних систем і алюмосилікатних розплавів (магм).
Якщо прийняти напругу реакції
2H+ + 2e- = 2H2
за нуль, то до цієї точки можна привести напруги, що виникають в інших реакціях ΔEH при певних температурах і тисках. В хімічній літературі зміну напруги порівняно із реакцією відновлення гідрогену прийнято позначати як стандартний окисний потенціал Eh. В стандартних умовах позначаємо Eh°. Значення Eh окремих пів реакцій при 25°С і 1 бар дані в таблиці 8.1. Значення Eh° можуть бути розраховані за рівнянням
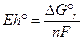
Якщо ми запишемо ΔG° через константу рівноваги, то отримаємо рівняння Нернста для окисного потенціалу

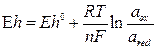 (8.1)
(8.1)
Для 25°С і 1 бар рівняння Нернста набуде вигляду
|
|
|
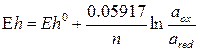 , (8.2)
, (8.2)
де R - газова стала; n - число електронів, що приймають участь в реакції; F - число Фарадея; a ox і a red - активності окислених і відновлених компонентів в ступенях, відповідних їх стехіометричним коефіцієнтам. Eh o - стандартний електронний потенціал
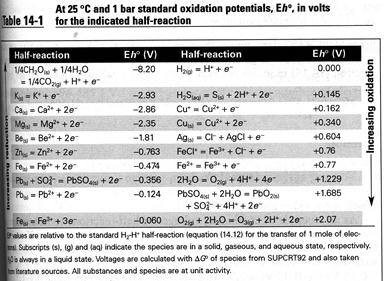
Таблиця 8.2. Стандарстний окисний потенціал E h °, в вольтах, для важливих пів-реакцій
 Стандартний водневий потенціал
Стандартний водневий потенціал
n E° = 0 для реакції

коли [H+] = 1 моль/л і PH2(g) = 1 бар.
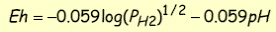
Системи з великими додатними окисними потенціалами є окисниками по відношенню до систем з менш додатними або від’ємними потенціалами. При контакті таких систем виникає реакція окиснення ↔ відновлення, яка веде до встановлення загального окисно-відновного потенціалу з якимось проміжним значенням. Наприклад, величина окисно-відновного потенціалу в природних водах відображає рівноважний окисно-відновний стан усіх підсистем, які знаходяться в даній воді і містять елементи зі змінною валентністю. Тому величина Eh служить найбільш загальним показником окисно-відновного режиму водних розчинів і відображає умови їх формування.
Як приклад використання рівняння Нернста, розглянемо воду при 25°С і 1 бар, що містить як Fe2+ так і Fe3+. Для цієї редокс-пари можна записати пів-реакцію окиснення
Fe2+ = Fe3 + + e-
Якщо моляльність Fe2+= 10-4 і Fe3+= 10-2, співвідношення ox/red складе 100. E h° реакції, рівне +0,77 В, візьмемо із табл. 8.2. У водному розчині із рівняння (8.2) отримаємо E h = 0,77+0,05917·log(100) = 0,884. Відповідно, якщо ми спостерігаємо напругу реакції, то можемо розрахувати активності сполук, що приймають у ній участь.
В останнє десятиліття як окисно-відновний показник геохімічних систем використовується параметр p e.
p e = -log ae-, де ae- –активність електронів у розчині, моль/кг H2O.
Можливі коливання окисно-відновного потенціалу визначаються полем стабільності води. Нижня границя E h і p e визначається за реакцією
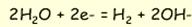


|
|
|

Верхня границя E h і p e за реакцією

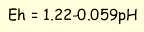
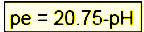

| 
|
| Рис. 8.3. E h -pH діаграма при 25°С і 1 бар, що показує поле стабільності води (затінено). дані значення фугітивності кисню в рівновазі із рідкою водою і області аеробних та анаеробних процесів. | Рис. 8.4. E h -pH діаграма що показує коливання реальних спостережень параметрів природних вод – метеорних, морських, седиментаційних (Walther, 2005). |

|

|
| Рис. 8.5. Приблизна позиція деяких природних середовищ|середи| на діаграмі Eh—рН (по Гаррелсу і Крайсту. Розчини, мінерали і рівноваги. М., Мир|світ|, 1968) | рН-Еh область стабільності води ділиться на чотири частини: 1. окисні кислі розчини; 2. окисні лужні розчини; 3. відновні лужні розчини; 4. відновні кислі розчини. Точка повної нейтральності розділяє ці частини |
Природні редокс-процеси, що відбуваються у гідротермальному процесі, відбуваються за участю елементів із змінною валентністю – Fe, S, C.
Зміна в часі піротину FeS піритом FeS2, а потім гематитом Fe2O3 відображає зростання окисного потенціалу гідротермального розчину.
При дегазації магми виділяється SO2 і при взаємодії цього газу із водою при температурах 600-500°C відбувається диспропорціювання сульфуру між сульфідною та сульфатною формами (сульфур у цій рееакції є і окисником і відновником)
4SO2 + 4H2O = H2S + 3H2SO4 (1)
4S4+ → S2- + 3S6+
-16 e - = 2 e - + (-18 e -)
Аналогічна реакція диспропорціювання спостерігається і в системі карбону
2C + 2H2O = CO2 + CH4 (2)
Сірководень, взаємодіючи із окисником (O2, Fe3+), окиснюється до сульфат-іону
H2S + 2O2 = HSO42- + H+ (3)
9H2S + 8Fe3+ = 8FeS + HSO42- + 17H+ (4)
S2- → S6+ + 8 e -
8Fe3+ + 8e- = 8Fe2+
Реакція піротин → пірит також є окисно відновною, так як формулу піриту можна записати як FeS2-S0
Тоді реакція буде виглядати наступним чином
4FeS + 3HS- + HSO42- + 4H+ = 4FeS2 + 4H2O (5)
3S2- → S0 + 6 e -
S6+ + 6 e -→ S0
Реакцію (5) можна записати і більш звичним чином
FeS + HS- + 0,5O2 + H+ = FeS2 + H2O (6)
S2- → S0 + 2 e -
O0 + 2 e - → O2-
Окиснювачем в такій реакції може виступати і CO2 і реакція набуде вигляду
FeS + HS- + 0,25CO2 + H+ = FeS2 + 0,25CH4 + 0,5H2O (7)
S2- → S0 + 2 e -
0,25С4+ + 8 e - → 0,25C4-
Як бачимо із рівнянь (5 - 7), один процес може проходити різними шляхами і різні окино-відновні пари можуть його контролювати. В даному випадку індикаторами окисно-відновного потенціалу виступають співвідношення HS-/SO42- та CH4/CO2, а також активність O2 в гідротермальному розчині. Традиційним є використання фугітивності O2 (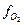 )як показника окисно-відновного потенціалу. У цьому випадку, мається на увазі фугітивнісь O2 в газовій суміші, що знаходиться у рівновазі із гідротермальним розчином даного складу. Значення
)як показника окисно-відновного потенціалу. У цьому випадку, мається на увазі фугітивнісь O2 в газовій суміші, що знаходиться у рівновазі із гідротермальним розчином даного складу. Значення 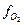 в гідротермальних системах складають 10-20 – 10-40 бар залежно від температури та складу, тому часту показуються у вигляді
в гідротермальних системах складають 10-20 – 10-40 бар залежно від температури та складу, тому часту показуються у вигляді  . Потрібно пам’ятати, що значення
. Потрібно пам’ятати, що значення  = -20 – - 40 бар вказують настільки низькі концентрації активного O2 в розчині, при яких реакція за рівнянням (6) відбуватися не може.
= -20 – - 40 бар вказують настільки низькі концентрації активного O2 в розчині, при яких реакція за рівнянням (6) відбуватися не може.
|
|
|
Зв’язок між E h і  можна вивести із реакції
можна вивести із реакції
4H+ + O2 + 4e- = 2H2O
Рівняння Нернста для цієї реакції при активності H2O=1 має вигляд
При 25°C і 1 бар, E h 0=1,23
Реальними є реакції (5) і (7), переважання кожної із них визначається складом розчину та кінетичними факторами.
Збільшення окисного потенціалу призводить до піриту до гематиту
8FeS2 + HSO4 + 16H+ = 4Fe2O3 + 17H2S
8Fe2+=2Fe3+ + 8e-
S6+ + 8e- = S2-
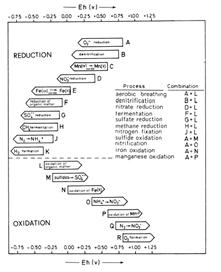
| Рис. 8.6. Природні редокс-процеси, що відбуваються в зоні гіпергенезу • аеробне дихання CH2O→O2 • денітрифікація • нітрат-редукція NO3-→ NO2- • ферментація CH2O→CO2 • сульфат-редукція SO4→H2S • метан-редукція CH4→CO2 • фіксація азоту N2→ NH4+ • окиснення сульфідів FeS → FeSO4 • нітрифікація NH4+→NO3- • окиснення феруму • окиснення мангану |
 Важливу роль у перебігу окисно-відновних процесів в зоні гіпергенезу відіграють мікроорганізми. Більшість вказаних вище редокс-процесів каталізуються бактеріями.
Важливу роль у перебігу окисно-відновних процесів в зоні гіпергенезу відіграють мікроорганізми. Більшість вказаних вище редокс-процесів каталізуються бактеріями.
 Для прикладу, Thiobacillus ferrooxidans, ацидофільна бактерія, окислює Fe2+, елементарну сірку і відновлює неорганічні сполуки сірки. Бактерія Thiobacillus ferrooxidans окислює елементарну сірку і відновлює неорганічні сполуки сірки, не зачіпаючи Fe2+. Ці бактерії діють при низьких значеннях E h. Бактеріальне окиснення органічної речовини призводить до швидкого зменшення концентрації кисню у розчині.
Для прикладу, Thiobacillus ferrooxidans, ацидофільна бактерія, окислює Fe2+, елементарну сірку і відновлює неорганічні сполуки сірки. Бактерія Thiobacillus ferrooxidans окислює елементарну сірку і відновлює неорганічні сполуки сірки, не зачіпаючи Fe2+. Ці бактерії діють при низьких значеннях E h. Бактеріальне окиснення органічної речовини призводить до швидкого зменшення концентрації кисню у розчині.

| Класифікація осадів за Бернером
| |||||||||||||
| Рис. 8.7. Лінії рівноваги типових редокс-реакцій на діаграмі E h -pH |
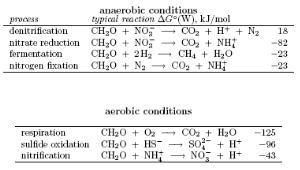
Збагачені поживними речовинами, евтрофіковані водойми є анаеробними. Як тільки органічна речовина не встигає знищувати кисень, що розчиняється у воді, встановлюються аеробні умови. Нижче показані основні редокс-реакції, що проходять за участю мікроорганізмів у аеробних і анаеробних умовах.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 1664; Нарушение авторских прав?; Мы поможем в написании вашей работы!