
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Ізомерія
ПОНЯТТЯ ПРО ГОМОЛОГІЮ
Однією з причин багато чисельності органічних сполук є існування гомологів, які утворюють гомологічні ряди.
Гомологічним рядом називається послідовність подібних за будовою та властивостями речовин, в якій кожний наступний член відрізняється від попереднього на постійну структурну одиницю – гомологічну різницю СН2.
Генетичною основою гомологічних рядів для більшості класів органічних сполук є гомологічний ряд насичених незамкнутих вуглеводнів – алканів (табл. 7.1).
Таблиця 7.1 – Гомологічний ряд алканів
| Будова, склад (у дужках) | Кількість атомів карбону в головному ланцюгу | Назва |
| СН4 (СН4) | Метан | |
| СН3-СН3 (С2Н6) | Етан | |
| СН3-СН2-СН3 (С3Н8) | Пропан | |
| СН3-(СН2)2-СН3 (С4Н10) | Бутан | |
| СН3-(СН2)3-СН3 (С5Н12) | Пентан | |
| СН3-(СН2)4-СН3 (С6Н14) | Гексан | |
| СН3-(СН2)5-СН3 (С7Н16) | Гептан | |
| СН3-(СН2)6-СН3 (С8Н18) | Октан | |
| СН3-(СН2)7-СН3 (С9Н20) | Нонан | |
| СН3-(СН2)8-СН3 (С10Н22) | Декан |
Загальна формула для алканів – CnH2n+2. Як видно із порівняння їх складу (табл.7.1), два найближчі сусідні гомологи дійсно відрізняються один від одного на гомологічну різницю СН2.
Подібним чином органічні сполуки будь-якого класу теж утворюють власні гомологічні ряди, кожний з них має свою загальну формулу. Наприклад, загальна формула для насичених одноатомних спиртів (тобто таких, що містять тільки одну групу ОН) – CnH2n+1OH, для насичених карбонових кислот – CnH2n+1COOH.
Для органічних сполук характерно явище ізомерії, що теж позначається на утворенні дуже великої кількості органічних сполук.
Ізомерія – це явище, при якому декілька сполук – ізомерів – мають однаковий склад і однакову молекулярну масу, але відрізняються один від одного будовою молекул, а отже, і своїми фізичними та хімічними властивостями.
Існують різні типи ізомерії, серед яких найбільш поширеними є структурна і просторова.
І Структурна ізомерія зумовлюється різним порядком розміщення окремих атомів чи атомних груп у молекулі. Вона поділяється на певні види:
· ізомерія карбонового ланцюгу, наприклад, для алканів складу С5Н12 існують три ізомери різної будови:
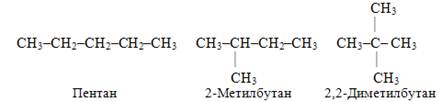
· ізомерія положення кратного зв’язку, наприклад, для ацетиленових вуглеводнів складу С5Н8, які мають лінійну будову:
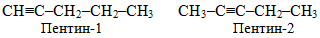
· ізомерія положення замісника, наприклад, для спиртів складу С3Н7–ОН можливо існування двох ізомерів:

· міжкласова ізомерія (так звана метамерія). Слід зазначити, що на відміну від інших структурних ізомерів, властивості яких відрізняються не дуже різко, метамери за своїми властивостями зовсім не походять один на одного. Так, для складу С5Н10, крім розглянутих видів структурної ізомерії, характерне ще й явище метамерії. Як приклад можна навести будову вуглеводнів, один з яких належить до алкенів, а інший – до циклоалканів:
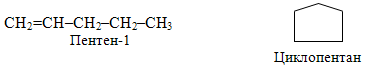
Інший приклад метамерії – ізомери складу С3Н6О, які належать до різних класів – альдегідів, кетонів і ненасичених спиртів:

Відома міжкласова ізомерія насичених карбонових кислот і естерів (складних ефірів), наприклад, метамери складу С3Н6О2:

ІІ Просторова ізомерія, при якій склад і послідовність сполучення атомів в молекулах ізомерів залишаються однаковими, але змінюється просторове розміщення однакових атомів чи атомних груп відносно карбонового ланцюгу. Просторова ізомерія представлена такими видами:
1) Геометрична ізомерія (інша назва – π-діастереомерія) зумовлена різним положенням замісників відносно подвійного зв’язку чи малого циклу. Геометричні ізомери, в яких обидва замісники (або продовження карбонового ланцюгу) розташовані по різні боки від подвійного зв’язку чи циклу, називаються транс-ізомерами, а ті, в яких замісники знаходяться з одного боку, – цис-ізомерами. Наприклад, для бутену-2, в якому подвійний зв’язок розміщується після другого атома карбону СН3–СН=СН–СН3 існує два геометричних ізомери (рис. 7.1).

Рисунок 7.1 – Геометричні ізомери бутену-2 (π-діастереомери)
Геометричні ізомери відрізняються фізичними показниками і реакційною здатністю, що пояснюється різним енергетичним станом цис - і транс -ізомерів. Транс -ізомери є більш стійкими, оскільки замісники в їх молекулах більш віддалені один від одного. Перехід геометричних ізомерів із однієї форми в іншу можливий тільки при обертанні навколо подвійного зв¢язку, для чого необхідно розірвати p-зв¢язок, витративши 263кДж/моль. Такий великий енергетичний бар¢єр обертання навколо подвійного зв¢язку С=С можна подолати при температурі вище 3000С. З цієї причини цис - і транс -ізомери існують в індивідуальному вигляді і самочинно не переходять один в одного.
Як приклад геометричної ізомерії можна навести чотири ізомери циклоалканів складу С6Н12, в основі будови яких лежить циклобутан С4Н8 з двома боковими ланцюгами СН3. Ця ізомерія пов¢язана із різним розташуванням замісників відносно площини циклу (рис. 7.2).

Рисунок 7.2 – Транс- і цис-ізомери (ліворуч і праворуч відповідно):
а) 1,2-диметилциклобутан; б) 1,3-диметилциклобутан
Геометрична ізомерія характерна не тільки для вуглеводнів, а і для сполук, що належать різним класам органічних речовин, наприклад, кислотам:

2) Оптична ізомерія (або стереоізомерія) у свою чергу поділяється на два види: конформаційну і конфігураційну.
а) Конформаційна стереоізомерія зумовлюється вільним обертанням груп атомів навколо σ-зв’язків між атомами карбону в ланцюгу.
Різні геометричні форми молекули, які можуть переходити одна в одну внаслідок обертання окремих атомів і атомних груп навколо зв’язків С–С, називаються конформаціями.
При обертанні навколо s-зв¢язків С–С молекула прагне набути найвигіднішої конформації з найменшою внутрішньою енергією. Варіантів таких конформацій дуже багато, але частіше зустрічаються дві:
· загальмована конформація, в якій атоми Н двох сусідніх метильних груп (СН3) віддалені на максимальну відстань; при цьому електронна взаємодія зв¢язків С–Н і потенціальна енергія молекули будуть найменшими (рис. 7.3а);
· заслонена конформація, в якій відстань між атомами гідрогену двох сусідніх метильних груп (СН3) найменша, тому зв¢язки С–Н в них взаємно відштовхуються; це приводить до збільшення потенціальної енергії молекули і, отже, до меншої міцності (рис. 7.3б).
Різниця в енергії заслоненої та загальмованої конформацій складає приблизно 10–12кДж/моль, тому за звичайних умов конформації легко переходять одна в одну. Виділити алкан у вигляді однієї індивідуальної конформації неможливо, їх існування вдається довести тільки за допомогою точних фізико-хімічних методів.
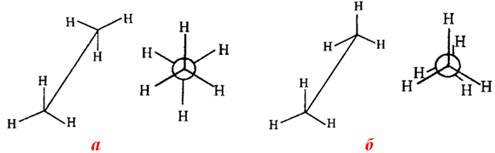
Рисунок 7.3 – Конформації молекули етана: а) загальмована;
б) заслонена
У міру збільшення довжини карбонового ланцюгу зростає кількість конформацій, тому молекули алканів можуть набувати різних форм. Якщо всі атоми карбону в ланцюгу перебувають в енергетично вигідній загальмованій конформації, то ланцюг має зигзагоподібну будову (рис. 7.4а). Карбоновий ланцюг може мати і клешневиду структуру (рис.7.4б), менш вигідну порівняно із зигзагоподібною. Однак кленшевида конформація спрощує замикання вуглецевого ланцюгу в цикл і утворення нових зв¢язків, а це в кінцевому підсумку дає виграш в енергії.

Рисунок 7.4 – Конформації молекули пентану С5Н12:
а) зигзагоподібна; б) клешевида
б) Конфігураційнастереоізомерія зумовлюється наявністю в молекулі асиметричних атомів карбону (в структурних формулах він позначається зірочкою: С*). Конфігураційні стереоізомери на відміну від конформаційних не здатні перетворюватися один в одного без розриву хімічних зв’язків (такий перехід може відбуватися тільки внаслідок хімічної реакції).
Асиметричним називається атом С, сполучений з чотирма різними замісниками. Асиметричний атом має й іншу назву – хіральний центр (від грецького χειρ – рука), яка наголошує на відсутність симетрії відносно лівого і правого боків. Наприклад, хіральним є відображення об’єкту в ідеально плоскому дзеркалі, яке відрізняється від самого об’єкту.
Існує тільки два варіанти тетраедричного розміщення чотирьох замісників навколо sp3-гібридизованого асиметричного атома С, які складають пару конфігураційних ізомерів – їх звичайно називають оптичними антиподами, або енантіомерами. Енантіомери подібно до співвідношення між правою та лівою рукавичками уявляють собою дзеркальні відображення одна одної (рис. 7.4).

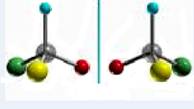
Рисунок 7.4 – Дзеркальне відображення sp3-гібридизованого асиметричного (або хірального) атома карбону з чотирма різними замісниками (на схемі символ атома С не записуєть, а його положення визначається перехрестям хімічних зв’язків)
Енантіомери за звичайних умов не відрізняються між собою ні за фізичними, ні за хімічними властивостями. Їх головною ознакою вважається оптична активність – здатність обертати площину поляризації світла, яка вперше була знайдена Луї Пастером.
|
|
Дата добавления: 2014-01-07; Просмотров: 4752; Нарушение авторских прав?; Мы поможем в написании вашей работы!