
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гібридизація атомних орбіталей
|
|
|
|
Різниця у формі та енергії атомних орбіталей повинна спричиняти утворення хімічних зв’язків С – Н, відмінних за своєю енергією. Однак дослідження доводять, що насправді зв’язки однакові завдяки явищу гібридизації.
Гібридизація – це процес змішування та вирівнювання орбіталей за формою і енергією, при якому відбувається перерозподіл електронних густин близьких за енергією орбіталей, внаслідок чого вони стають рівноцінними.
Для валентних орбіталей збудженого атома карбону можливі три типи гібридизації.
s p-Гібридизація. При комбінації однієї s- i однієї р-орбіталей виникають дві sp-гібридизовані орбіталі, розміщені симетрично під валентним кутом 1800 (рис. 7.7).
Валентним називається кут між вісями зв’язку – уявними лініями, які проходять через ядра хімічно сполучених атомів.
Зв’язки, які утворюються за участю електронів валентних орбіталей, також розміщуються під кутом 1800, що зумовлює лінійну форму молекули. Такий тип гібридизації спостерігається в молекулах вуглеводнів з потрійними зв’язками (наприклад, в ацетилені НСºСН).
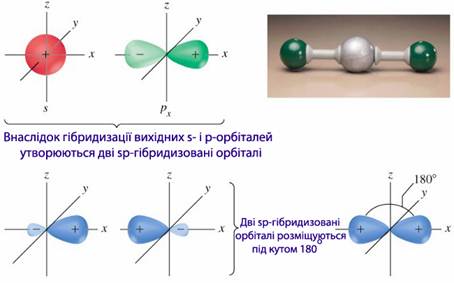
Рисунок 7.7 – Загальна схема sp-гібридизації
s p2-Гібридизація. Комбінація однієї s- і двох р-орбіталей приводить до утворення sp2-гібридизованих зв'язків, розміщених під кутом 1200 (рис. 7.8). Тому фрагмент молекули, в якому зв’язки утворені за рахунок sp2-гібридизованих орбіталей, набуває форми правильного трикутника. Наприклад, збуджений атом карбону С*(2s12p3) перебуває у стані sp2-гібридизації в молекулі етилену (Н2С=СН2). Три гібридизовані орбіталі кожного атому карбону утворюють три зв’язки: два з атомами гідрогену (С–Н) і один з сусіднім атомом карбону (С–С), а негібридизовані р-орбіталі утворюють ще один додатковий зв’язок між атомами карбону.
|
|
|
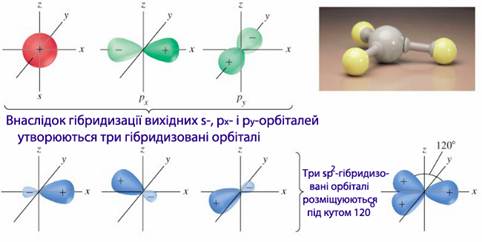
Рисунок 7.8 – Схема sp2-гібридизації атомних орбіталей і плоска трикутна форма молекули, зумовлена sp2-гібридизацією атомних орбіталей
sp3-Гібридизація. Комбінація чотирьох орбіталей (однієї s- і трьох р-) приводить до sp3-гібридизації, при якій чотири гібридизовані орбіталі симетрично орієнтовані у просторі до чотирьох вершин тетраедра, тобто під кутом 109028` (рис. 7.9). Тетраедричне розміщення зв’язків зумовлює тетраедричну форму молекул, що характерно для насичених сполук чотиривалентного карбону (СН4, СCl4, C2H6).
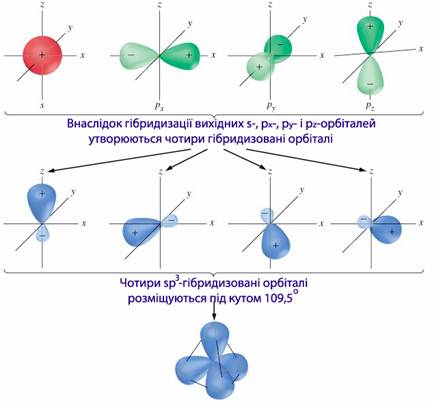
Рисунок 7.9 – Схема sp3-гібридизації атомних орбіталей і тетраедрична форма молекули, що зумовлена sp3-гібридизацією
Так, в молекулі метану СН4 атом карбону, який в основному стані мав електронну структуру 2s22p2, а після збудження – 2s12p3, піддається sp3-гібридизації, причому кожна з чотирьох гібридизованих орбіталей містить по одному неспареному електрону:
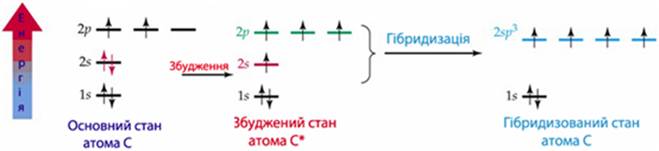
і утворює чотири рівноцінні зв’язки при перекриванні з сферичними 1s-орбіталями чотирьох атомів Н. Це сприяє симетричному перекриванню електронних орбіталей у вершинах уявного тетраедру з атомом С* у центрі (рис. 7.10).

Рисунок 7.10 – Тетраедрична форма молекули СН4, що зумовлюється sp3-гібридизацією орбіталей атома С*
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4233; Нарушение авторских прав?; Мы поможем в написании вашей работы!