
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Властивості ковалентного зв’язку
|
|
|
|
В органічних сполуках найчастіше здійснюється ковалентний тип хімічного зв’язку. Зв’язок атомів за допомогою спільних електронних пар називається ковалентним.
Для скорочення спільні пари електронів позначаються рискою між символами атомів відповідних елементів: С–Н, С–С, С–Cl.
Сутність ковалентного зв’язку пояснюється спеціальними теоріями, серед яких найбільш доступною є модель валентних зв’язків (так званий метод ВЗ). Основні положення методу ВЗстисло можна викласти так:
1. Кожна пара атомів у молекулі утримується разом за допомогою однієї або декількох спільних електронних пар, при цьому електронні орбіталі взаємодіючих атомів перекриваються. Графічно утворення ковалентних зв’язків за рахунок неспарених електронів подають за допомогою точок, які позначають зовнішні електрони атома;
2. Міцність зв’язку залежить від ступеня перекривання електронних орбіталей;
3. Умовою утворення ковалентного зв’язку є анти-напрямленість спінів електронів
(↑↓); завдяки цьому виникає узагальнена електронна орбіталь з найбільшою електронною густиною у між’ядерному просторі, що забезпечує притягання позитивно заряджених ядер один до одного і супроводжується зменшенням загальної енергії системи.
Для ковалентного зв’язку використовують такі характеристики: валентний кут, довжина і енергія зв’язку, напрямленість, насиченість, кратність, поляризація та поляризованість тощо. Енергія і довжина зв’язку були розглянуті у §7.3.2, тепер розглянемо інші.
1)Напрямленість ковалентного зв’язку. Відповідно до методу ВЗ хімічний зв’язок між атомами зумовлюється перекриванням орбіталей, які, за винятком s-орбіталей, мають напрямленість у просторі.
|
|
|
Напрямленість ковалентного зв’язку – це таке розміщення електронної густини між атомами, яке забезпечує максимальне перекривання електронних орбіталей.
Оскільки електронні орбіталі мають різні форму і орієнтацію у просторі, то їхнє взаємне перекривання може реалізуватися різними способами. Залежно від цього розрізняють s- і p- зв’язки.
Сигма-зв’язок (s-зв’язок) – це таке перекривання електронних орбіталей, при якому максимальна електронна густина концентрується вздовж вісі зв’язку – уявної лінії, що з’єднує два ядра.
Сигма-зв’язок може утворюватися за рахунок двох s-електронів, одного s- і одного р-електрона, двох р-електронів або за участю гібридних орбіталей. Ознакою сигма-зв’язку є наявність однієї області перекривання, зосередженої між ядрами атомів (рис. 7.14).

Рисунок 7.14 – Схема перекривання електронних орбіталей при утворенні s-зв’язків
На відміну відs-зв’язку, при якому найбільша електронна густина локалізується на вісі зв’язку, p- зв’язок характеризується боковим перекриванням валентних орбіталей (рис. 7.15).
Пі-зв’язок ( p- зв’язок) – це перекривання електронних орбіталей, при якому максимальна електронна густина концентрується з обох боків від вісі, що з’єднує ядра атомів.
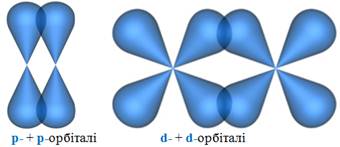
Рисунок 7.15 – Схема перекривання електронних орбіталей при утворенні p-зв’язків
Різна розміщення електронної густини при утворенні σ- і π-зв’язків визначає їх характерні особливості:
· π-Зв’язок менш міцний порівняно з σ-зв’язком, оскільки осьове перекривання орбіталей і розташування електронної густини σ-зв’язку в між’ядерному просторі є більш ефективним і енергетично вигідним;
· σ-Зв’язок сприяє можливості внутрішньомолекулярного обертання атомів без розриву зв’язку, а π-зв’язок такого обертання не допускає (без розриву зв’язку);
· Електрони при π-перекриванні, які знаходяться збоку від меж’ядерного простору, мають б і льшу рухливість, ніж σ-електрони, тому π-зв’язок здатний сильно деформатуватися під впливом зовнішнього силового поля, тобто виявляє значну схильність до поляризації (див. нижче), ніж σ-зв’язок.
|
|
|
2)Кратність – ще одна властивість ковалентного зв’язку.
Кратність – це характеристика ковалентного зв’язку, яка визначається числом спільних електронних пар, що сполучають атоми.
Ковалентний зв’язок за кратністю може бути одинарним (простим), подвійним і потрійним (рис. 7.16).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 4030; Нарушение авторских прав?; Мы поможем в написании вашей работы!