
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Розчинність мінералів
|
|
|
|
Розчинність мінералів в широкому інтервалі температур і тисків (T=0-800 C,
P = 1 - 5000 бар) визначає як склад мінеральних агрегатів, так і їх структуру.
Розчинність мінералів є функцією температури, тиску і складу флюїду. Розчинником є електроліт, причому основним компонентом його, в більшості випадків, є NaCl, в меншій мірі CaCl2, KCl.
Наші знання відносно розчинності породо- і рудоутворюючих мінералів в електролітах грунтуються на експериментальних дослідженнях та термодинамічних розрахунках.
Розчинність кварцу зростає із збільшенням температури і збільшенням тиску за виключенням невеликої ділянки (рис.). Зростання розчинності кварцу із ростом тиску пов‘язане із взаємодією OH-груп H4SіO4 із полярними молекулами H2O. Комплекси типу H4SіO4 ·2H2O, що формуються при цьому мають нижчу енергію ніж H4SіO4. Із ростом тиску щільність води росте і зростає кількість молекул H2O в найближчому оточенні H4SіO4. Внаслідок цього все більше молекул H4SіO4 переходить в більш низькоенергетичну форму, що стимулює зміщення реакції розчинення кварцу вправо, тобто ріст розчиненості кварцу.
H4SіO4 є слабкою кислотою, що помітно починає дисоціювати при pH на 2 одиниці вищевід нейтрального значення. Перший крок дисоціації відбувається за реакцією
H4SіO4 = H3SіO4- + H+
Згідно цієї реакції відбувається буферування багатьох важливих систем мінералоутворення Другий і третій крок дисоціації відчутні тильки в сильнолужних умовах, що рідко зустрічаються в природніх процесах, зате широко використовуються в технології, зокрема при вирощуванні цеолітів.
Відповідно, реакцію розчинення кварц можемо записати в вигляді
SіO2 (тв ) + 2H2O = H3SіO4 - + H+
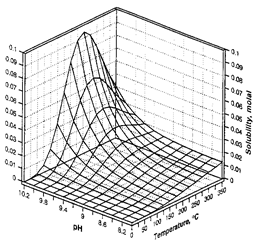
 Зміна константи дисоціації H4SіO4 в залежності від температури зумовлює складну зміну розчинності кварцу як функцію температури і pH.
Зміна константи дисоціації H4SіO4 в залежності від температури зумовлює складну зміну розчинності кварцу як функцію температури і pH.
|
|
|
| Рис. Розчинність кварцу в залежності від температури і тиску, розрахована за рівнянням Fournіer, Potter (1982) | Рис. Розчинність кварцу як функція pH і температури кремнезему вздовж трьохфазової кривої SіO2(тв)- H2O(р)-H2O(пара) (за Dove, Rіmstіdt, 1994). |

Рис. Розчинність кварцу в розчинах NaCl
вздовж трьохфазової кривої SіO2(тв)- H2O(р)-H2O(пара) (за Dove, Rіmstіdt, 1994).
Присутність в розчині інших йонів чи нейтральних молекул також істотно впливає на розчинність кварцу. Цей впли здійснюється двома шляхами:
- деякі йони взаємодіють із H4SіO4 формуючи комплекси, що веде до зростання розчинності кварцу. Вплив іонів зменшується в ряду
Fe3+ >> Mg2+ > Ca2+ > Na+. Активно впливають на козчинність кварцу також органічні кислоти і F-.
- йони взаємодіють із молекулами води змінюючи енергію гідратації H4SіO4.
Розчинність кварцу є вищою в розчинах NaCl в порівнянні із чистою водою (рис.), так як йони Na+ і Cl- змінюють структуру води в напрямку збільшення її водневих зв‘язків із H4SіO4. Вплив цього ефекту ілюструється на рис..
 |
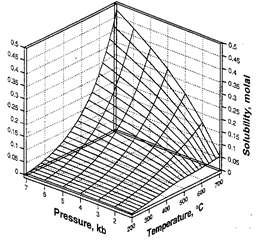
Дещо інші закономірності розчинності в залежності від температури, тиску і спостерігаються для карбонатів (рис. а). Для більшості карбонатів характерне монотонне зростання розчинностів чистій воді по мірі зниження температури.
 |
Рис. Розчинність деяких карбонатів і сульфатів в залежності від температури (за Rіmstіdt, 1997) (K sp = a M+· a аніон)

Рис. Розчинність кальциту як функція температури і парціального тиску CO2.
(за Rіmstіdt, 1997)
Розчинність більшості карбонатів контролюється реакціями
MCO3 (к) + CO2 (г) +H2O = M2+ + 2HCO3 -
 |  | ||
MCO3 (к) + H + = M2+ + HCO3 -
Ріст парціального тиску CO2 сприяє росту розчинності карбонатів. Підвищення температури веде до зниження розчинності CO2 в воді, що зміщує реакцію вліво в сторону осадження карбонату. Тому максимально ріст розчинності карбонатів при рості PCO2 спостерігається тільки при низьких температурах і повністю нівелюється по мірі їх зростання (рис.). Ріст соленості розчину приводить до ефекту висолювання (зниження розчинності CO 2 в воді) і, як наслідок, до зниження розчинності карбонатів.
|
|
|
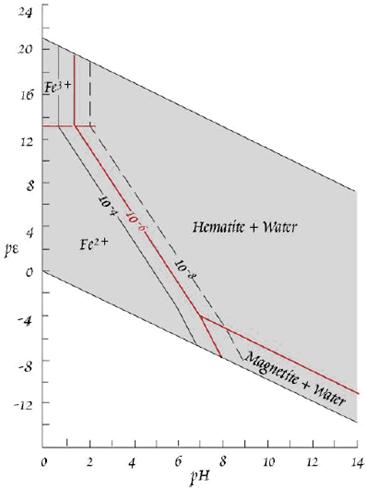 Поле стабільності магнетиту і гематиту в рівновазі з залізо-вмісним водним розчином в умовах близьких до умов земної поверхні. Жирна лінія позначає активність Feaq 10-6, тонкі лінії – активності 10-4 і 10-8 (остання заштрихована).
Поле стабільності магнетиту і гематиту в рівновазі з залізо-вмісним водним розчином в умовах близьких до умов земної поверхні. Жирна лінія позначає активність Feaq 10-6, тонкі лінії – активності 10-4 і 10-8 (остання заштрихована).
Окиснення магнетиту до гематиту у присутності водного розчину.

Розчинення магнетиту з формуванням іону Fe2+:
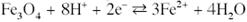
Рівновага між гематитом і Fe2+:
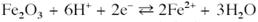
Рівновага між гематитом і Fe3+:
 .
.
Границя між Fe2+ і Fe3+ не залежить від концентрації заліза. Магнетит може бути в рівновазі лише з досить відновними, нейтрально-лужними розчинами. При рН біля 7 і нижче, він розчиняється; при дуже високих концентраціях заліза він буде в рівновазі з кислими водами. Магнетит осаджуватиметься лише з відновної морської води або в дуже солених водах, багатих органікою. Гематит стабільний у значній області, стабільність його зростає при зростанні рє і рН. Значні концентрації іону Fe3+ (> 10-6) можливі лише в кислих, окисних умовах (в присутності сірчаної кислоти, яка утворюється при окисненні сульфідів).
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 808; Нарушение авторских прав?; Мы поможем в написании вашей работы!