
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Разветвленные цепные реакции
|
|
|
|
Кинетика неразветвленных цепных реакций
Если в выражении I = Dа/D n величины D а и D n определять для Dt = 1, то D а = v - скорости реакции:
v = I × D n.
Таким образом, если каким-либо способом можно определить длину цепи и число молекул активного продукта, образующихся в единицу времени, то можно найти и скорость реакции. I и D n - функции времени. После некоторой задержки, в течение которой происходит зарождение цепей, реакция протекает спокойно с постепенно уменьшающейся скоростью.
Скорость простых цепных реакций обычно подчиняется простым кинетическим уравнениям, но часто из-за больших значений длины цепи константы скорости таких реакций имеют аномально высокое значение.
Для расчёта реакций такого типа широко применяют принцип стационарности Боденштейна (см. лекцию 40). Хотя вывод кинетических уравнений и не представляет большой трудности, сложность расчёта заключается в том, что в подавляющем большинстве случаев детальный механизм реакции не известен. Практически не существует метода составления схемы цепной реакции, однозначно удовлетворяющей эмпирически найденному кинетическому уравнению. Обычно сначала составляют вероятную схему, а полученное из неё уравнение реакции сравнивают затем с данными опыта.
Если происходит разветвление цепей и если число новых цепей, возникающих в короткий период времени, больше числа обрывающихся цепей, то скорость реакции быстро увеличивается и может произойти взрыв, хотя температура и не повышается настолько, чтобы был возможен тепловой взрыв. Переход реакции во взрывной режим возможен только при вполне определенных давлениях (или концентрациях) и температурах реагирующей смеси. При данной температуре существуют пределы давлений, в области которых возможен взрыв или самовоспламенение. Такого типа взрыв называется цепным.
|
|
|
Реакции самовоспламенения были известны давно, но объяснение они получили относительно недавно, главным образом благодаря работам Н.Н.Семенова и его сотрудников. Они объяснили эти процессы как реакции с разветвленными цепями и показали важную роль дезактивации (гибели) активных частиц на стенках и в объеме, вследствие чего скорость реакции оказывается зависящей от размеров сосуда. Были установлены два предела взрыва (самовоспламенения) для множества реакций.
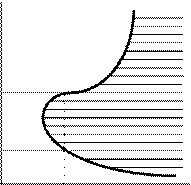
Если построить зависимость давления, при котором происходит воспламенение, от температуры, то во многих случаях кривая выглядит так, как показано на рис. 12. Вся область, расположенная слева от кривой АВС, соответствует условиям, при которых самовоспламенение невозможно. Процесс самовоспламенения газовой смеси возможен только в заштрихованной области. При некоторой заданной температуре Т1 существует нижний критический предел давления р 1 , ниже которого самовоспламенение невозможно, и верхний критический предел давления р 2 , выше которого самовоспламенение также невозможно. Качественно наблюдаемое явление объясняется следующим образом. При низких давлениях, меньших р 1 , среднее число актов обрыва цепей превышает число актов разветвления цепей, и горение становится невозможным. При давлениях выше р 1 вероятность обрыва цепей уменьшается, так как из-за столкновений частиц уменьшается вероятность достижения активными частицами стенок сосуда. При дальнейшем повышении р наблюдается второе критическое давление р 2 ; при этом вновь среднее число актов обрыва цепей начинает превышать число актов разветвления цепей, но обрыв цепей происходит уже не на стенках, а в объеме в результате тройных столкновений.
|
|
|
 р
С
р 2
В
р 1
А
Т1 Т р
С
р 2
В
р 1
А
Т1 Т
| Рис. 12. Зависимость температуры воспламенения от давления смеси в разветвленных цепных процессах |
Величина р 1 убывает с повышением Т по закону е E/RT. Значение р 1 зависит от обработки материала сосуда, его диаметра, состава смеси; положение точки В, так называемого мыса полуострова самовоспламенения, зависит от этих же параметров. Разбавление реакционной смеси инертным газом понижает значение р 1 . Эти закономерности объясняются тем, что прибавление инертного газа и увеличение диаметра сосуда затрудняет диффузию активных центров к стенке, что вызывает уменьшение скорости реакций обрыва и приводит к понижению критического давления р 1 .
Величина р 2 растет с повышением температуры по закону е – E/RT и очень мало зависит от величины поверхности, диаметра и формы сосуда.
Опыт показывает, что в ряде случаев наблюдается не два, а три предела самовоспламенения, или взрываемости; после перехода через этот третий предел снова начинается интенсивное самовоспламенение. В большинстве случаев третий предел имеет чисто тепловую природу, но в некоторых случаях (в частности, в реакции Н2 + О2) он имеет цепной характер. Теоретически можно показать, что третий предел как цепной возможен в случаях, когда на стенках реакционного сосуда происходит не только гибель свободных радикалов, но и образование новых свободных радикалов за счет реакции свободных радикалов с адсорбированными молекулами, и, кроме того, когда при высоких давлениях оказываются возможными тройные соударения, приводящие к зарождению цепей.
Цепной процесс вне пределов концентраций, температур и давлений, необходимых для самовоспламенения и взрыва, возможен, но он будет затухающим.
Важной характеристикой цепных процессов является так называемый период индукции t, который, строго говоря, характеризует время, в течение которого концентрация промежуточного продукта (активных центров реакции) увеличивается в е раз. На практике под периодом индукции понимают условную величину - время, в течение которого скорость процесса переходит от незначительной неизмеримой величины к очень большой измеримой величине. Обычно из-за лавинообразного нарастания скорости процесс вначале развивается медленно, а через определенный промежуток времени начинает идти с большой и все возрастающей скоростью.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 707; Нарушение авторских прав?; Мы поможем в написании вашей работы!