
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Гомогенные каталитические реакции
Общие сведения о катализе
Катализ кислотами и основаниями
Общие сведения о катализе. Гомогенный катализ.
Катализом называется изменение скорости химической реакции под действием веществ, которые в результате реакции оказываются химически неизменными. Эти вещества называются катализаторами.
Скорость химической реакции под действием катализаторов может или возрастать, или падать. В первом случае катализ называется положительным, во втором случае – отрицательным.
Количество катализатора, необходимое для изменения скорости реакции, всегда очень невелико. В первом приближении скорость химической реакции изменяется прямо пропорционально концентрации катализатора.
Катализатор принимает участие в самом химическом процессе. Он участвует в промежуточных стадиях реакции, выделяясь к концу реакции вновь в химически неизменённом виде. Поэтому твёрдые катализаторы в результате реакции часто из крупнокристаллической формы переходят в мелкокристаллическую.
Учитывая сказанное, катализ можно определить как изменение числа и характера элементарных стадий, из которых слагается химический процесс, под действием катализатора.
Катализатор в случае обратимой реакции не смещает положения равновесия: константа скорости прямой и обратной реакций в присутствии катализатора изменяется в одинаковое число раз.
Действие каждого катализатора специфично: он изменяет скорость только одной реакции или группы определённых реакций. Например, в присутствии оксида алюминия этанол разлагается на этилен и воду, а в присутствии меди – на ацетальдегид и водород.
Реакции, в которых катализатором являются исходные или конечные продукты, называются автокаталитическими.
Каталитические реакции по фазовому составу участников и катализатора удобно разделить на гомогенные и гетерогенные. Если все участники (исходные и конечные продукты) и сам катализатор находятся в одной фазе, такие реакции называют гомогенными; если же участники реакции и катализатор находятся в разных фазах, реакции называют гетерогенными.
Катализ играет очень большую роль в природе и технике. Подбирая соответствующим образом катализаторы, можно вести процессы в нужном направлении с желаемой скоростью.
Примером гомогенных каталитических реакций являются этерификация и омыление сложных жиров, катализируемые кислотами, разложение пероксида водорода под действием ионов в растворе, инверсия сахарозы и мутаротация глюкозы в присутствии кислот и оснований, полимеризация олефинов в жидкой фазе под действием серной кислоты и др. Очень широко распространены гомогенные каталитические реакции в природе. Синтез белков и обмен веществ в биологических объектах совершаются в присутствии биокатализаторов, получивших название ферментов или энзимов.
Химические процессы обычно идут через промежуточное активное состояние. В случае гомогенных каталитических реакций таким переходным состоянием является образование промежуточного соединения, чаще всего соединения одного из исходных веществ с катализатором. Хотя экспериментальное обнаружение промежуточных веществ – задача очень трудная, в некоторых случаях их образование все же установлено.
Ускорение процесса при участии катализатора в большинстве случаев происходит за счет меньшей энергии активации образования активированного комплекса с катализаторм по сравнению с энергией активации образования активированного комплекса без катализатора.
Рассмотрим для примера бимолекулярную реакцию, проходящую в отсутствие катализатора по схеме
А + В ® АВ¹ ® С +....
В присутствии ускоряющего катализатора К реакция протекает по схеме:
1) образование промежуточного продукта АК в результате обратимого взаимодействия между катализатором и одним из исходных веществ
А + К 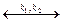 АК
АК
(k 1 – константа скорости прямой реакции, k 2 – константа скорости обратной реакции);
2) образование активированного комплекса в результате взаимодействия промежуточного продукта АК со вторым компонентом реакции
АК + В  (АВ¹ )К;
(АВ¹ )К;
активированный
комплекс
3) образование конечных продуктов и регенерация катализатора
(АВ¹ )К  К + С +....
К + С +....
Для некаталитического процесса изменение потенциальной энергии в ходе реакции имеет уже известный вид (см. рис. 10). В каталитическом процессе вначале происходит образование промежуточного вещества, в результате чего потенциальная энергия системы будет отличаться от исходного состояния на теплоту образования вещества АК; затем образуется активированный комплекс (АВ¹ )К (энергия которого соответствует высоте потенциального барьера), после чего распад (АВ¹ )К приводит к конечному состоянию по энергии, совпадающему с таковым для некаталитического процесса. Если переход от активированного комплекса в отсутствие катализатора к активированному комплексу, возникающему в ходе каталитического процесса, является экзотермическим, то есть
АВ¹ + К ® (АВ¹ )К + DН
(где DН < 0), то энергия активации каталитического процесса будет на DЕ меньше энергии активации процесса, протекающего в отсутствие катализатора. Схема, иллюстрирующая снижение энергии активации при каталитическом процессе, изображена на рис. 13.
Энергия активации при использовании активных катализаторов снижается по сравнению с энергией активации процесса, протекающего в отсутствие катализатора, примерно на 40 кДж/моль и больше. Поэтому при температуре 300 К скорость каталитической реакции больше скорости реакции в отсутствие катализатора примерно в 2,5×108 раз.

| Рис. 13. Потенциальные кривые для некаталитического (1) и гомогенного каталитического (2) процессов |
Образование активированного комплекса с участием катализатора из активированного комплекса, возникающего в ходе реакции и в отсутствие катализатора, должно быть экзотермическим процессом. В противном случае будет иметь место отрицательный катализ.
Общая схема расчета кинетики гомогенных каталитических реакций
Для представленной выше схемы каталитической реакции легко вывести уравнение, определяющее скорость ее протекания. Согласно теории активированного комплеса скорость реакции определяется скоростью его распада на конечные продукты
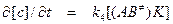 . (1)
. (1)
Концентрацию активированного комплекса (АВ¹)К можно найти следующим образом. Спустя некоторое время после начала процесса, согласно принципу стационарности, скорость образования активированного комплекса будет составлять
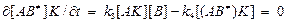 , (2)
, (2)
откуда  . (3)
. (3)
Так как реакция образования промежуточного продукта АК обратима, согласно принципу стационарности имеем
 , (4)
, (4)
откуда находим
 . (5)
. (5)
Подставляя (5) в (3) и полученное выражение в (1), находим
 . (6)
. (6)
Из уравнения (6) видно, что скорость реакции оказывается прямо пропорциональной концентрации катализатора, что хорошо согласуется с опытом.
Если константа скорости распада промежуточного вещества на исходные продукты значительно превышает константу скорости образования активированного комплекса, то есть k 2 >> k 3, то
 . (7)
. (7)
Скорость реакции оказывается прямо пропорциональной концентрации катализатора и реагирующих веществ. Промежуточное вещество при этом называется промежуточным веществом Аррениуса.
Если же, наоборот, константа скорости образования активированного комплекса много больше константы скорости распада промежуточного вещества, то есть k 2 << k 3, то все количество промежуточного вещества превращается в конечные продукты, а скорость реакции, как видно из выражения (6), оказывается прямо пропорциональной концентрации того исходного вещества, которое взаимодействует с катализатором, образуя промежуточное вещество:
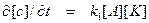 .
.
В этом случае промежуточное вещество носит название промежуточного вещества Вант-Гоффа.
|
|
Дата добавления: 2014-01-07; Просмотров: 3569; Нарушение авторских прав?; Мы поможем в написании вашей работы!