
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Катализ кислотами и основаниями
|
|
|
|
Многие реакции в растворах ускоряются в присутствии ионов водорода и гидроксила, например, этерификация кислот и спиртов, гидролиз сложных эфиров, инверсия сахаров и др.
Оствальд в 1884 г. нашел правило, согласно которому сила каталитического действия прямо пропорциональна электропроводности кислот. Эта закономерность была подтверждена Аррениусом, который, кроме того, установил две новые (солевые эффекты).
Прибавление нейтральной соли, не имеющей общего иона с катализирующей реакцию кислотой, способно увеличивать каталитическое действие. Например, скорость инверсии тростникового сахара в присутствии уксусной кислоты возрастает на 30% при прибавлении 10% (мол.) NaCl (первичный солевой эффект).
Прибавление к катализирующей реакцию кислоте ее соли (согласно классической теории кислот и оснований это должно уменьшать концентрацию ионов водорода) приводит не к уменьшению каталитического эффекта, а в некоторых случаях даже к увеличению (например, при этерификации трихлоруксусной кислоты).
Прежде чем рассматривать механизмы и кинетику гомогенных химических реакций, ускоряемых кислотами и основаниями, напомним определения кислот и оснований.
Согласно определениям, предложенным Бренстедом и Лоури, кислота – это вещество, являющееся донором протона, а основание – вещество, являющееся акцептором протонов. Кислота и основание, связанные уравнением
 ,
,
называются сопряженными. Протон в растворах обычно соединяется с молекулами рстворителя. Если молекулы растворителя не способны ни присоединять, ни отдавать протоны, то растворенное вещество не может проявлять ни кислотных, ни основных свойств. Такой растворитель называется апротонным. Вещество только тогда может проявлять кислотные свойства, когда растворитель является акцептором протонов. Такой растворитель называется протофильным.
|
|
|
Раствор кислоты в воде представляет собой систему двух пар сопряженных кислот и оснований
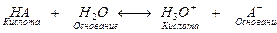 .
.
Одна пара сопряженных кислот и оснований – НА и А–, другая – Н3О+ и Н2О.
В водных растворах оснований также имеются две пары сопряженных кислот и оснований

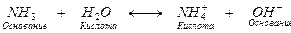 .
.
Одна пара сопряженных кислот и оснований NH4+ и NH3, другая Н2О и ОН–.
Как видно из этих примеров, вода может выступать и как основание, и как кислота. Вещества, способные отдавать и присоединять протон, называются амфипротными. Следовательно, кислотами и основаниями могут быть не только молекулы, но и ионы. Таким образом, в теории Бренстеда – Лоури основным признаком кислоты считается наличие в ее молекуле протона. Эта теория исключает возможность проявления кислотного характера веществами, не содержащими водорода, например SnCl4, BF3, AlCl3, ZnCl2 и другими, кислотные свойства которых хорошо известны.
По Льюису, кислота – вещество, способное использовать свободную пару электронов другой молекулы для образования устойчивой электронной оболочки, а основание – вещество, обладающее свободной парой электронов, которая может быть использована для образования устойчивой электронной конфигурации другого атома. Льюисовские кислоты и основания могут и не содержать протонов и, следовательно, являться апротонными. Всякое равновесие, связанное с использованием молекулой свободной электронной пары другой молекулы, следует рассматривать как кислотно-основное.
В зависимости от природы катализаторов различают несколько типов катализа кислотами и основаниями.
Каталитические реакции, ускоряемые кислотами, можно разделить на три типа: 1) специфический кислотный катализ, при котором активация субстрата осуществляется ионами Н3О+ ; 2) общий кислотный катализ с активацией субстрата любым донором протонов, кроме Н3О+, то есть под действием так называемых обобщенных кислот Бренстеда; 3) электрофильный катализ, когда катализаторами являются кислоты Льюиса.
|
|
|
Каталитические реакции, ускоряемые основаниями, также можно разделить на три типа: 1) специфический основной катализ с активацией субстрата ионами гидроксила ОН– ; 2) общий основной катализ с активацией субстрата с помощью любого акцептора протона, кроме ОН– , то есть катализ, происходящий под действием обобщенных оснований Бренстеда; 3) нуклеофильный катализ под действием оснований Льюиса.
Если в каталитической реакции одновременно участвуют бренстедовские кислота и основание, то такую каталитическую реакцию называют реакцией общего кислотно-основного катализа; если в реакции одновременно участвуют кислота и основание Льюиса, такую реакцию называют реакцией электрофильно-нуклеофильного катализа. Когда общий кислотно-основной или электрофильно-нуклеофильный катализ осуществляется одновременно (синхронно) путем тримолекулярного столкновения, такой механизм называется пуш-пульным.
Специфический катализ
Примером специфического кислотного катализа может явиться гидролиз сложных эфиров. В сильнокислых растворах эта реакция ускоряется только ионами гидроксония; выражение для ее скорости имеет вид
 ,
,
где [S] – концентрация субстрата, в данном случае сложного эфира.
При специфическом щелочном гидролизе скорость реакции прямо пропорциональна концентрации гидроксильных ионов, то есть
 .
.
Отличие основного катализа от кислотного состоит в том, что активный промежуточный продукт образуется не при внедрении, а при отрыве протона от субстрата. Иногда он возникает при внедрении гидроксила в реагирующую группу субстрата.
Отнесение реакций к специфическому кислотному или щелочному катализу делается только на основании вида кинетического уравнения, а не на основании детального механизма процесса.
По механизму специфического кислотного катализа протекает реакция инверсии сахарозы, гидролиз ацеталей, гидратация ненасыщенных альдегидов. По механизму специфического основного катализа протекает альдольная конденсация, гидратация альдегидов, гидролиз сложных эфиров.
|
|
|
Общий кислотный и общий основной катализы
Общий кислотный катализ, так же как и специфический, связан с внедрением протона в реагирующую часть молекулы субстрата и с электронной атакой молекулы воды. Отличие от механизма специфического кислотного катализа состоит лишь в том, что донором протона является не Н3О+, а любая кислота НА Бренстеда. В общем кислотном катализе часто оказывается, что медленной стадией является не распад, а образование катиона SH+ (S-субстрат). По механизму общего кислотного катализа протекает гидратация и дегидратация альдегидов, гидролиз некоторых эфиров.
Общий основной катализ тоже схематически протекает так же, как и специфический. Различие схем (помимо того, что акцептором является не ОН–, а обобщенное основание Бренстеда) обычно сводится только к различию лимитирующих стадий. Для специфического основного катализа характерное быстрое образование и медленный распад промежуточного комплекса, а для общего основного катализа характерен медленный процесс образования промежуточного активного аниона S–.
Примером общего основного катализа является разложение нитрамида в водном растворе карбоновых кислот:
NH2NO2 ® NO2 + H2O
Скорость этой реакции в широком интервале рН не зависит от концентрации водородных и гидроксильных ионов. Было найдено, что константа скорости этой реакции первого порядка в присутствии уксусной кислоты подчиняется уравнению
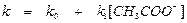
Общий кислотно-основной катализ
Примером общего кислотно-основного катализа является реакция мутаротации глюкозы.
Изменение циклической структуры, вследствие которого достигается равновесное значение удельного вращения, протекает через ациклическую форму. Явление изменения удельного вращения называется мутаротацией. Реакция мутаротации протекает как в воде, так и в некоторых органических растворителях. Она ускоряется введением в смесь и кислот, и оснований; в зависимости от их концентрации константа скорости может быть определена следующим эмпирическим уравнением:
|
|
|
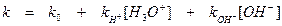
В некоторых органических растворителях (пиридине, хлороформе, м -крезоле) при полном отсутствии воды мутаротация полностью прекращается. Это явление объясняется следующим образом. Для каталитической мутаротации глюкозы необходимо одновременное присутствие и кислоты (донора протонов), и основания (акцептора протонов). Вода может быть и акцептором, и донором протона, поэтому ее каталитическое действие понятно. В растворителях, не содержащих водорода (апротонные растворители), может осуществляться лишь общий кислотный или основной катализ, так как ионы, аналогичные ионам гидроксония и гидроксила, при этом отсутствуют.
Однако в смеси одной части пиридина с двумя частями м -крезола мутаротация протекает в 20 раз быстрее, чем в воде. Пиридин обладает только основными свойствами, м -крезол – только кислотными, и в их смеси соблюдается необходимое условие общего кислотно-основного катализа – одновременное присутствие кислоты и основания.
Электрофильный и нуклеофильный катализы
Соединения, способные присоединяться к свободной электронной паре – электронные акцепторы, или кислоты Льюиса, играют роль катализаторов в тех случаях, когда возникающий комплекс обладает повышенной реакционной способностью. Опыт показывает, что апротонные кислоты катализируют те же реакции, что и протонные кислоты, причём активность апротонных кислот иногда выше, чем протонных. Возникающие комплексы имеют ионный характер и даже диссоциированы с образованием промежуточного активного продукта катионного типа.
Типичными апротонными кислотами являются галогенидные соединения адюминия, бора, хлорид цинка, тетрахлорид олова.
Аналогично апротонным кислотам ведут себя иногда ионы металлов (железа, меди, никеля). Активный промежуточный продукт образуется при этом в результате двухцентрового взаимодействия иона с субстратом и является хелатом. Субстатами могут быть эфиры и амиды дикарбоновых кислот, аминокислоты, некоторые кетокислоты. Процесс во второй стадии, как и во всяком кислотном катализе, протекает с участием основания.
Реагируя с водой, апротонные кислоты превращаются в протонные, например:
Cl
ï
AlCl3 + H2O Û [ Cl – Al – OH ]– H+
ï
Cl
Сила протонной кислоты из-за сильного смещения электрона от протона оказывается больше апротонной. Так, из кислот Льюиса образуют протонные бренстедовские кислоты:
BF3 + HF Û HBF4 Û H+ + BF4–
AlCl3 + HCl Û HAlCl4 Û H+ + AlCl4–
Соединения со свободной элекронной парой – основания Льюиса – в ряде реакций играют роль основных катализаторов. Отличие нуклеофильного катализа от общего основного заключается в том, что в случае основного катализа обычно происходит отщепление протона, а в случае нуклеофильного – нет.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3351; Нарушение авторских прав?; Мы поможем в написании вашей работы!