
КАТЕГОРИИ:
Архитектура-(3434)Астрономия-(809)Биология-(7483)Биотехнологии-(1457)Военное дело-(14632)Высокие технологии-(1363)География-(913)Геология-(1438)Государство-(451)Демография-(1065)Дом-(47672)Журналистика и СМИ-(912)Изобретательство-(14524)Иностранные языки-(4268)Информатика-(17799)Искусство-(1338)История-(13644)Компьютеры-(11121)Косметика-(55)Кулинария-(373)Культура-(8427)Лингвистика-(374)Литература-(1642)Маркетинг-(23702)Математика-(16968)Машиностроение-(1700)Медицина-(12668)Менеджмент-(24684)Механика-(15423)Науковедение-(506)Образование-(11852)Охрана труда-(3308)Педагогика-(5571)Полиграфия-(1312)Политика-(7869)Право-(5454)Приборостроение-(1369)Программирование-(2801)Производство-(97182)Промышленность-(8706)Психология-(18388)Религия-(3217)Связь-(10668)Сельское хозяйство-(299)Социология-(6455)Спорт-(42831)Строительство-(4793)Торговля-(5050)Транспорт-(2929)Туризм-(1568)Физика-(3942)Философия-(17015)Финансы-(26596)Химия-(22929)Экология-(12095)Экономика-(9961)Электроника-(8441)Электротехника-(4623)Энергетика-(12629)Юриспруденция-(1492)Ядерная техника-(1748)
Кинетика гетерогенных каталитических реакций
|
|
|
|
Кинетика процессов, в которых реагирует одно вещество и продукты реакции не тормозят процесс
Рассмотрим гетерогенные каталитические реакции, когда катализатор твердый, а реагирующие вещества и продукты реакции газообразные, причем вначале ограничимся случаем, когда реагирует одно вещество и продукты реакции не тормозят процесса. Примерами такого типа реакций могут быть реакции распада некоторых веществ, например, распад NH3 на платине, распад метана на угле и др.
Как уже было сказано, в типичном гетерогенном процессе реагируют только те вещества, которые адсорбированы на поверхности. Скорость v гетерогенной химической реакции определяют как количество вещества, реагирующего в единицу времени на единице площади поверхности катализатора
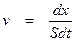 , (1)
, (1)
где x – количество реагирующего вещества в момент времени t; S – общая площадь катализатора, на которой идет химический процесс.
Скорость гетерогенного химического процесса согласно основному постулату химической кинетики прямо пропорциональна поверхностной концентрации веществ. Последняя прямо пропорциональна доле поверхности s, занятой молекулами реагирующего вещества на единице площади катализатора, поэтому можно записать
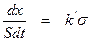 . (2)
. (2)
Так как поверхность данного катализатора постоянна, величину общей поверхности катализатора можно ввести в константу скорости процесса k ’, то есть принять, что
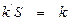 . (3)
. (3)
Поэтому уравнение (2) запишется в более простом виде:
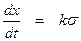 . (4)
. (4)
Площадь, занятую реагирующим веществом на одном квадратном сантиметре поверхности, можно найти, пользуясь адсорбционной теорией Ленгмюра. Сделаем упрощающие предположения: 1) между адсорбированными молекулами не действуют силы притяжения и отталкивания; 2) процесс адсорбции заканчивается тогда, когда все адсорбционные центры на поверхности твердого тела (или жидкости) оказываются занятыми, то есть на поверхности раздела фаз образуется слой толщиной в одну молекулу (мономолекулярный насыщенный слой); 3) все адсорбционные центры одинаковы во всех отношениях. Тогда можно считать, что скорость процесса адсорбции v 1 будет прямо пропорциональна давлению газа и свободной поверхности катализатора 1 – s:
|
|
|
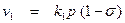 , (5)
, (5)
где k 1 – константа, характеризующая скорость процесса адсорбции.
Скорость v 2 обратного процесса (десорбции) будет прямо пропорциональна поверхности, занятой реагирующими молекулами
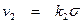 , (6)
, (6)
где k 2 – константа, характеризующая процесс десорбции.
В момент равновесия скорости обоих противоположных процессов должны быть равны: v 1 = v 2 . Приравнивая правые части выражений (5) и (6), находим
 . (7)
. (7)
Решая это уравнение, получим
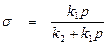 . (8)
. (8)
Разделив числитель и знаменатель на k 2 и обозначив k 1/ k 2 = b, получим
 . (9)
. (9)
Коэффициент b называют адсорбционным коэффициентом. Из уравнения (9) следует, что если адсорбция слабая, то s << 1, и, следовательно, b << 1, поэтому величиной bр в знаменателе можно пренебречь. Выражение (9) при этом переходит в
s = bр, (10)
то есть при малых давлениях поверхность, занятая адсорбированным веществом, прямо пропорциональна давлению. Эта область получила название области линейной адсорбции. Если адсорбция сильная, то bр >> 1, и в знаменателе выражения (9) можно пренебречь единицей, при этом оно переходит в выражение
s = 1. (11)
Это выражение является уравнением асимптоты уравнения (9). Кривая, соответствующая уравнению (9), показана на рис. 16.
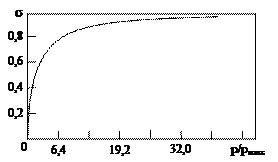
| Рис. 16. Зависимость доли поверхности, занятой молекулами реагирующего вещества на единице площади катализатора, от давления |
Считая, что скорости процессов адсорбции и десорбции много больше скорости химического процесса на поверхности твердого катализатора, то есть считая, что лимитирующей стадией является стадия химического процесса, и пользуясь уравнением (9) и вытекающими из него уравнениями, для предельных случаев (10) и (11) можно получить удобные для расчетов уравнения кинетики гетерогенных реакций.
|
|
|
Если реагирует одно вещество и адсорбция его мала, то, подставив в выражение (3) значение s из равенства (10), получаем
dx / dt = kbp. (12)
Если мы введем обозначение kb = k *, то выражение (12) запишется в виде
dx / dt = k * p. (13)
Как видно, уравнение кинетики гетерогенной реакции в этом случае соответствует уравнению первого порядка, так как концентрация реагирующего вещества, выраженная через его парциальное давление р, входит в выражение (13) в первой степени.
Для интегрирования уравнения (13) надо парциальное давление реагирующего вещества выразить через число молей:
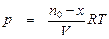 , (14)
, (14)
где n 0 – число молей исходного вещества в начальный момент времени; х – число молей прореагировавшего исходного вещества; V – общий объем системы.
Подставим выражение (14) в (13) и приведем полученное выражение к виду, удобному для интегрирования. Общий объем системы V – величина постоянная, так как процесс в статических условиях обычно ведут при постоянном объеме. Поскольку переход от парциальных давлений к числу молей реагирующего вещества, как видно из рассмотренного примера, очень прост, в дальнейшем это преобразование будем опускать.
Константа k *, входящая в уравнение кинетики, называется кажущейся константой скорости процесса, она является произведением истинной константы скорости химической реакции на адсорбционный коэффициент b.
Примерами реакций, кинетика которых подчиняется уравнению (13), могут служить реакции распада мышьяковистого водорода AsH3 и фосфористого водорода РН3 на стекле, распад NO2 на золоте, иодистого водорода на платине, метана на угле и др.
Если реагирующее вещество адсорбируется умеренно, то, подставляя выражение (8) в (4), получим
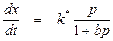 . (15)
. (15)
Это выражение приближенно можно записать в виде
 . (16)
. (16)
Как видно, порядок такой реакции получается дробным. Он равен 1/m (m – некоторое целое число). Такой дробный порядок является кажущимся. Истинный порядок реакции, протекающий на поверхности катализатора, является первым. Кажущийся порядок мы получаем потому, что в уравнение кинетики, согласно принятому нами методу расчета, входят величины, характеризующие изменение концентрации вещества не непосредственно на поверхности, а в объеме. В выражение (15) входит не поверхностная концентрация, которая характеризуется величиной s, а величина, характеризующая содержание реагирующего вещества в объеме, – его парциальное давление р. Поверхностная концентрация, которая прямо пропорциональна величине s, входит в уравнение кинетики (4) в первой степени, и, следовательно, истинный порядок реакций первый. Примером реакции с дробным кажущимся порядком является реакция распада аммиака на мышьяке.
|
|
|
Если адсорбция реагирующего вещества сильная, то s = 1; подставляя (11) в (4), получим
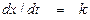 . (17)
. (17)
Кажущийся порядок реакции при этом получается нулевым, то есть можно считать, что парциальное давление реагирующего вещества в это выражение входит в нулевой степени (р 0 = 1). Кроме того, в выражение (17) в противоположность уравнениям (13), (15), (16) входит истинная константа скорости процесса.
Важно отметить, что кажущийся порядок гетерогенных реакций может для одной и той же реакции изменяться от нулевого, когда реакция проводится под большим давлением, через переменный дробный порядок до первого порядка, когда давление реагирующего вещества становится очень малым. Это вполне понятно, если вспомнить следствия, вытекающие из уравнения (8), определяющего поверхность, занятую реагирующим веществом.
Кинетика процессов, в которых реагирует одно вещество и продукты реакции тормозят процесс
Рассмотрим кинетику процессов, скорость которых тормозится продуктами реакции. Это может происходить вследствие того, что продукты реакции адсорбируются на поверхности катализатора и тем самым уменьшают поверхность, занятую реагирующим веществом. Таким образом, при расчете поверхности, занятой реагирующим веществом, надо учитывать адсорбцию продуктов распада. Для простоты будем рассматривать процессы, когда адсорбируется, а следовательно, и тормозит процесс только один продукт реакции. Расчет кинетики, когда процесс тормозят несколько конечных продуктов, в принципе проводят тем же путем.
|
|
|
Согласно теории Ленгмюра, если адсорбируются два вещества (исходное и продукт), для скорости v 1 адсорбции исходного вещества А имеем
v 1 = k 1 p A (1 – sA – sB),
где k 1 – константа, характеризующая скорость процесса адсорбции вещества А; p A – парциальное давление этого вещества; sA и sB – доли поверхности, занятые на единице площади адсорбента или катализатора веществами А и В соответственно. Величина 1 – sA – sB есть доля свободной поверхности. Для скорости процесса десорбции вещества А можно написать
v 2 = k 2 sA.
В момент равновесия скорости процессов адсорбции и десорбции будут равны и, следовательно,
k 1 p A (1 – sA – sB) = k 2 sA. (18)
Для второго вещества (продукта реакции), которое также адсорбируется на поверхности, путем аналогичных рассуждений получим выражение
k 1¢ p B (1 – sA – sB) = k 2¢ sB, (19)
где k 1¢ и k 2¢ – константы, характеризующие скорости процессов адсорбции и десорбции соответственно; p B – парциальное давление образующегося вещества В.
Решая уравнения (18) и (19) совместно, находим
sА = b p A / (1 + b p A + b ¢ p B), (20)
sB = b ¢ p B / (1 – b p A – b ¢ p B), (21)
где b = k 1/ k 2 и b ¢ = k 1¢/ k 2¢ – адсорбционные коэффициенты веществ А и В соответственно.
Если реагирует только одно вещество и рекция на поверхности следует уравнению первого порядка (истинный порядок), то уравнение кинетики химического процесса запишется следующим образом:
dx / dt = k sA. (22)
Выражение (20) позволяет рассчитать величину поверхности, занятой реагирующим веществом, а тогда с помощью уравнения (22) можно рассчитать кинетику химического процесса. Рассмотрим несколько случаев такого расчета.
1. Реагирующий газ адсорбируется слабо, продукт реакции умеренно. Из этих условий вытекает, что bp A << 1 и этой величиной в знаменателе выражения (20) можно пренебречь, то есть
sA = b p A / (1 + b ¢ p B). (23)
Подставляя (23) в (22), получим
dx/dt = k * p A / (1 + b ¢ p B). (24)
Примером реакции, кинетика которой подчиняется уравнению (24), является реакция распада N2O на платине. Процесс распада тормозит кислород.
2. Реагирующее вещество адсорбируется слабо, продукт сильно. В этом случае, согласно сказанному выше, bp A << 1, a b ¢ p B >> 1 и, следовательно, в знаменателе выражения (20) можно пренебречь единицей и величиной bp A как очень малыми по сравнению с величиной b ¢ p B, тогда выражение (20) запишется в виде
sA = b p A / b ¢ p B. (25)
Подставляя (25) в (22), получим
dx/dt = k * p A / p B. (26)
Примером такого процесса является разложение аммиака на платине. Процесс сильно тормозится образующимся водородом, который адсорбируется на поверхности платины.
3. Реагирующее вещество и продукт реакции адсорбируются сильно. В этом случае bp A >> 1 и b ¢ p B >> 1. В знаменателе выражения (20) можно пренебречь единицей, следовательно,
sA = b p A / (bp A + b ¢ p B). (27)
Подставляя (126) в (128), получим
dx/dt = k * p A / (bp A + b ¢ p B). (28)
Примером такой реакции служит реакция дегидратации этанола на оксиде алюминия. Сильно тормозит процесс образующаяся в результате реакции вода.
|
|
|
|
|
Дата добавления: 2014-01-07; Просмотров: 3331; Нарушение авторских прав?; Мы поможем в написании вашей работы!